 |
 |
|
Diese Webseite verwendet Cookies, um die Nutzerfreundlichkeit zu verbessern. Durch die weitere Nutzung der Webseite stimmen Sie dem zu. Weitere Infos zu Cookies und deren Deaktivierung finden Sie hier
|
 |
 |
|
Titelregister zu:
|
 |
 |
|
Sulfate
Sulfate sind Salze oder Ester der Schwefelsäure. Die Salze enthalten das Sulfat-Anion [SO4]2- bzw. das Hydrogensulfat-Anion [HSO4]-. Die Ester der Schwefelsäure haben die allgemeine Formel R-O-SO2-O-R', dabei sind R und/oder R' organische Reste.
Nomenklatur
Primäre und sekundäre Sulfate
Die Salze der zweibasigen Säure Schwefelsäure (H2SO4) lassen sich in Sulfate und Hydrogensulfate einteilen (auch als primäre und sekundäre Sulfate bezeichnet). Bei einwertigen Kationen MI gelten die Summenformeln MIHSO4 und MI2SO4:
|
 |
|
|
|
|
- Hydrogensulfate (primäre Sulfate)
|
|
|
Synonyme
|
- saure Sulfate
- Hydrogensulfate
- Bisulfate
|
- neutrale Sulfate
- normale Sulfate
|
|
Beispiele
|
- Natriumhydrogensulfat, NaHSO4
- Calciumhydrogensulfat, Ca(HSO4)2
|
- Natriumsulfat, Na2SO4
- Calciumsulfat, CaSO4
|
|
 |
 |
|
Alaune und Vitriole
Alaune sind Doppelsalze aus ein- und dreiwertigen Kationen mit der allgemeinen Summenformel MIMIII(SO4)2 · 12 H2O, Hauptvertreter der Gruppe der Alaune ist das Kaliumaluminiumsulfat (Kalialaun). Vitriole hingegen sind die kristallwasserhaltigen Sulfate zweiwertiger Nebengruppen-Metalle (Kupfervitriol, Eisenvitriol etc.).
Sulfatkomplexe
Sulfatgruppen können in Komplexen als Liganden auftreten. Die Liganden werden in diesem Fall als [Tetraoxosulfato(−2)] oder [Sulfato(−2)] bezeichnet. Nach Empfehlungen zur Nomenklatur tragen auch Sulfitgruppen (SO3)2− das Suffix -sulfat und werden als Trioxosulfat bzw. [Trioxosulfat(IV)] bezeichnet.
Ester der Schwefelsäure
Schwefelsäureester werden gelegentlich auch als Sulfate bezeichnet, da die Namen häufig auf -sulfat enden. Einfache Ester wie Dimethylsulfat sind kräftige Alkylierungsmittel. Ester mit längeren Kohlenwasserstoffresten sowie Sulfonsäure-Salze sind in der Regel Tenside. Zu diesen Estern gehören auch die anwendungstechnisch wichtigen Fettalkoholsulfate.
- Monoester; Beispiel: Natriumlaurylsulfat, ein Tensid, das in Shampoos verwendet wurde.
- Diester; Beispiel: Dimethylsulfat, ein Reaktand, der in Labor und Technik zur Methylierung verwendet wird.
Eigenschaften
Allgemeines
Die meisten Sulfate sind in Wasser löslich. Ausnahmen bilden die wenig oder schwerlöslichen Sulfate der Erdalkalimetalle Calcium, Strontium und Barium sowie Blei(II)-sulfat.
Besonders die Alkali- und Erdalkalisulfate sind thermisch äußerst stabil. Sulfate dreiwertiger Metallkationen zersetzen sich in der Wärme zu den entsprechenden Oxiden und Schwefeltrioxid:
|
 |
|
|
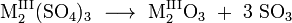 |
 |
 |
|
Hydrogensulfate sind als Salze der Alkalimetalle bekannt. Sie sind löslich in Wasser. Beim Erhitzen dieser Salze bilden sich Disulfate, Salze der Dischwefelsäure.
Anionen und pH-Wert
Schwefelsäure ist eine starke zweiprotonige Säure. In einer einmolaren, wässrigen Lösung der Säure liegen so gut wie keine H2SO4-Moleküle, sondern im Wesentlichen HSO4−-Ionen vor. Nur gut 1 % der HSO4−-Ionen deprotonieren zu SO42−. Das Hydrogensulfat-Anion (HSO4−) kann sowohl als Säure als auch als Base wirken, es ist also amphoter. Der pKS-Wert des Hydrogensulfat-Ions liegt bei 1,89.
Löst man ein Hydrogensulfatsalz in Wasser, bildet sich in einer Gleichgewichtsreaktion eine Mischung von Hydrogensulfat- und Sulfationen. Daher kann man Hydrogensulfate als mittelstarke Säure einsetzen, wobei die Säurestärke erheblich höher ist als die von Essigsäure (pKS = 4,76). Aufgrund dieser Eigenschaften können Hydrogensulfate auch in Pufferlösungen verwendet werden. Der Pufferbereich liegt im stark sauren Bereich. Wegen ihrer sauren Reaktion in Wasser werden sie beispielsweise in WC-Reinigern eingesetzt.
Vorkommen
Sulfate stellen für viele metallische Elemente die wichtigsten mineralischen Verbindungen dar. Quellen des Sulfates im Bodengestein sind z. B. Anhydrit (CaSO4), Gips (CaSO4 · 2 H2O) und Alabaster (CaSO4 · 2 H2O). Biologische Quelle sind (bakterielle) Sulfatbildungen aus Sulfid und schwefelhaltigen Biomasse-Bestandteilen (z. B. Proteinen). Sulfate kommen in unterschiedlichen Mengen im Grundwasser vor. Für daraus gewonnenes Trinkwasser gilt nach der deutschen Trinkwasserverordnung ein Grenzwert von 240 mg/l.
Struktur des Sulfations
Das Sulfation ist tetraedrisch gebaut, die S-O - Bindungen sind alle gleichwertig und gleichlang. Die Bindungsverhältnisse können entweder durch mesomere Grenzstrukturen mit delokalisierten π-Bindungen und zwei negativ geladenen Sauerstoffatomen oder durch Ladungstrennung mit zweifach positiv geladenem Schwefelatom und negativer Ladung an jedem Sauerstoffatom beschrieben werden. Es ist isoelektronisch mit dem Perchloration. Aus dem Molekülorbitaldiagramm geht hervor, wie die Bindung und die Hypervalenz erklärt werden kann. Es wird ein zweifach positiv geladenes Schwefelatom mit vier einfach besetzten Atomorbitalen angenommen. Diese Orbitale werden mit vier einfach besetzten 2p-Orbitalen aus den einfach negativ geladenen Sauerstoffatomen kombiniert. Es entstehen vier bindende und vier antibindende σ-Orbitale, von denen nur die bindenden vollständig aufgefüllt sind, und damit das tetraedrische Molekülgerüst mit vier lokalisierten Einfachbindungen. Die unbesetzten antibindenden σp*-Orbitale werden anschließend mit je einem voll besetzten p-Orbital dreier Sauerstoffatome kombiniert, es entstehen drei bindende und drei antibindende π-Orbitale, wovon wieder nur die bindenden Orbitale besetzt sind. Es resultieren drei π-Bindungen, die über das gesamte Molekül, also über das Schwefelatom und alle vier Sauerstoffatome, delokalisiert sind.
Nachweis
Sulfate werden chemisch mit Bariumchlorid oder Bariumhydroxidlösung in Salzsäure nachgewiesen. Dabei entsteht ein schwerlöslicher Niederschlag aus weißem Bariumsulfat:
|
 |
|
|
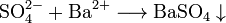 |
 |
 |
|
Sulfat-Ionen bilden mit Barium-Ionen einen weißen, säureunlöslichen Niederschlag von Bariumsulfat.
Die Säure wird zur Entstörung zugesetzt, da andere Anionen wie Carbonat oder Sulfit mit Barium in Wasser ebenfalls schwerlösliche, aber in Säuren lösliche Salze bilden.
In der Wasseranalytik finden für die quantitative Bestimmung auch titrimetrische Verfahren Anwendung.
Beispiele
- Alaun (Kaliumaluminiumsulfat, KAl(SO4)2 · 12 H2O, und ähnliche Alaune wie z. B. Ammoniumeisen(III)-sulfat)
- Aluminit (Al2[(OH)4SO4] · 7 H2O, ein Mineral)
- Anhydrit (Calciumsulfat, CaSO4, kristallwasserfrei - mit Kristallwasser auch als Gips, weiß, wasserunlöslich - s. u.)
- Blei(II)-sulfat (PbSO4, bildet sich durch Schwefelsäure-Einwirkung auf den Bleiplatten in Autobatterien, weiß, wasserunlöslich)
- Calciumaluminatsulfat, Ca6Al2[(OH)12|(SO4)3]·26 H2O
- Baryt (Bariumsulfat, BaSO4)
- Chromalaun (Kaliumchromsulfat-hydrat, Chrom(III)-kaliumsulfat-Dodecahydrat, KCr(SO4)2 · 12 H2O) und ähnliche Alaune
- Cobalt(II)-sulfat (CoSO4 · 7 H2O, ein Vitriol)
- Gips (wasserhaltiges Calciumsulfat, CaSO4 · 2 H2O) und Alabaster (kristallines Calciumsulfat)
- Eisen(II)-sulfat (FeSO4) Grünsalz, kristallwasserhaltig auch als Eisenvitriol bezeichnet
- Kaliumhydrogensulfat ((KHSO4), als saurer Abflussreiniger im Handel)
- Levosalbutamol·Sulfat (CAS-Nr. 148563-16-0), das Salz eines basischen Amins
- Magnesiumsulfat (MgSO4) kristallwasserhaltig auch als Bittersalz bezeichnet
- Mangan(II)-sulfat (MnSO4, kristallwasserhaltig auch als Manganvitriol bezeichnet, blassrosa)
- Mohr'sches Salz, auch: Ammoniumeisen(II)-sulfat, ein hellgrünes Doppelsalz aus Ammonium- und Eisen(II)-sulfat
- Natriumsulfat (Na2SO4) kristallwasserhaltig auch als Glaubersalz bezeichnet
- Natriumhydrogensulfat (NaHSO4)
- Nickelsulfat (NiSO4) kristallwasserhaltig auch als Nickelvitriol bezeichnet, grün
- Kupfer(II)-sulfat, kristallwasserhaltig auch als Kupfervitriol bezeichnet, hellblau
- Zinksulfat (ZnSO4 · 7 H2O, Zinkvitriol)
Prototypen der Vitriole, Alaune und weiterer Sulfate sind:
|
 |
|
|
|
Tabelle: Weitere Salze der Schwefelsäure
|
|
 |
|
|
|
Name
|
Formel
|
Trivialname / Farbe und Wasserlöslichkeit
|
|
Kaliumsulfat
|
K2SO4
|
Kalisulfat, schwefelsaures Kalium / farblos, löslich
|
|
Natriumsulfat
|
Na2SO4
|
Glaubersalz / farblos, löslich
|
|
Bariumsulfat
|
BaSO4
|
Malerweiß / weiß, unlöslich
|
|
Calciumsulfat
|
CaSO4
|
Gips, Anhydrit (je nach Kristallwassergehalt) / weiß, kaum löslich
|
|
Ammoniumsulfat
|
(NH4)2SO4
|
Ammonsulfat, Düngesalz / farblos, löslich (saure Reaktion)
|
|
Kupfersulfat
|
CuSO4
|
Kupfervitriol (mit Kristallwasser) / blau, wasserlöslich
|
|
Aluminiumsulfat
|
Al2(SO4)3
|
Alaun (Bestandteil neben Kaliumsulfat und Kristallwasser) / farblos, wasserlöslich
|
|
Eisen(III)-sulfat
|
Fe2(SO4)3
|
Eisensulfat, farblos, sehr gut wasserlöslich
|
|
 |
|
Weitere Beispiele siehe Kategorie:Sulfat
|
|
 |
 |
|
Der obige Ergänzungsartikel einschließlich der Bilder wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Citrobacter
Bei den Bakterien der Gattung Citrobacter handelt es sich um eine Gruppe gramnegativer Stäbchenbakterien der Familie der Enterobakterien (Enterobacteriaceae).
Die drei Citrobacter-Arten Citrobacter freundii, C. koseri (früher C. diversus genannt) und C. amalonaticus nutzen verschiedene organische Stoffe als Energie- und Baustoffquelle in oxidativem oder fermentativem Energiestoffwechsel. Sie können mit Citrat als einziger Energiequelle wachsen. Verbreitet sind die Citrobacter-Arten in beinah allen Lebensräumen wie etwa dem Boden, in Gewässern und in Abwässern. Außerdem kommen sie als Teil der Darmflora im Magen-Darm-Trakt des Menschen vor. Als Krankheitserreger spielen die Bakterien nur selten eine Rolle und können dann leichte Harnwegsinfektionen auslösen. Ebenfalls selten stehen Citrobacter-Arten im Zusammenhang mit Säuglings-Meningitis
Citrobacter können durch die Phosphataseaktivität in ihrer Zellwand Plutonium [Pu(IV)] aus wässriger Lösung ausfällen und als Lanthan-Phosphat-Komplex binden.[1]
Citrobacter sind wie einige andere Prokaryoten in der Lage, Stickstoff zu fixieren. Sie sind diazotroph. C. freudii wurde im Darm von Mittelmeerfruchtfliegen gefunden und es wird vermutet, das der von den Bakterien fixierte Stickstoff eine relevante Quelle organischen Stickstoffs für die Insekten ist. Somit leben ähnlich wie bei den Termiten die Fliegen mit ihren Darmbakterien in einer Symbiose.[2]
Arten
- Citrobacter amalonaticus (Young et al. 1971) Brenner & Farmer 1982
- Citrobacter braakii Brenner et al. 1993
- Citrobacter farmeri Brenner et al. 1993
- Citrobacter freundii (Braak 1928) Werkman & Gillen 1932
- Citrobacter gillenii Brenner et al. 2000
- Citrobacter koseri Frederiksen 1970
- Citrobacter murliniae Brenner et al. 2000
- Citrobacter rodentium Schauer et al. 1996
- Citrobacter sedlakii Brenner et al. 1993
- Citrobacter werkmanii Brenner et al. 1993
- Citrobacter youngae Brenner et al. 1993
Literatur
- Stichwort „Citrobacter“ in Pschyrembel Medizinisches Wörterbuch. 261. Auflage, Walter de Gruyter, Berlin 2007; Seite 350
Einzelnachweise
- ↑ P. Yong, L. E. Macaskie: "Bioaccumulation of Lanthanum, Uranium and Thorium, and Use of a Model System to develop a Method for the Biologically-mediated Removal of Plutonium from Solution", in: J. Chem. Technol. Biotechnol., 1998, 71, S. 15–26; Abstract .
- ↑ A. BEHAR, B. YUVAL, E . JURKEVITCH : Enterobacteria-mediated nitrogen fixation in natural populations of the fruit fly Ceratitis capitata. Molecular Ecology 2005,14: 2637–2643.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Haemophilus - Haemophilus influenzae
(Weitergeleitet von Haemophilus influenzae)
Bei den Bakterien der Gattung Haemophilus handelt es sich um eine Gruppe stäbchenförmiger gramnegativer Bakterien der Familie der Pasteurellaceae. Die 16 Arten dieser Bakterien sind unbewegliche Stäbchen, die mitunter in den Schleimhäuten von Menschen und Tieren leben und Erkrankungen auslösen können. Beinahe alle Haemophilus-Arten sind in der Lage, ohne Sauerstoff zu überleben; allerdings sind sie meistens eher aerob (fakultativ anaerob). Der Name der Gruppe kommt von ihrer besonderen Vorliebe für Nährböden mit Blut- oder Hämoglobinzusätzen, auf denen sie in Kultur gehalten werden können.
Medizinisch bedeutsame Arten
Haemophilus influenzae
Das auch als Pfeiffer-Influenzabakterium bekannte Bakterium stellt den bekanntesten Vertreter der Haemophilus-Arten dar. Es verfügt über die Fähigkeit, DNA aus der Umgebung aufzunehmen (siehe: Kompetenz). Seine Popularität wurde besonders dadurch erhöht, dass es 1995 als erstes Lebewesen vollständig sequenziert wurde und somit einen wichtigen Meilenstein der Genomforschung darstellt.
Haemophilus influenzae lebt ausschließlich in den Schleimhäuten des Menschen, vor allem in denen des oberen Atmungssystems (Nase, Rachen, Luftröhre) und verursacht dort entzündliche Erkrankungen (Epiglottitis, Bronchitis, Pneumonie). Übertragen wird das Bakterium vor allem als Tröpfcheninfektion, außerhalb der Schleimhäute ist es nur kurz lebensfähig. Aufgrund seiner Präsenz besonders bei Grippeerkrankungen hielt man es früher für den Erreger der Grippe, bis man das Grippevirus als tatsächlichen Verursacher identifizieren konnte. H. influenzae wird daher bei der Grippe als Erreger sekundärer Symptome angesehen, der von der Schwächung des Menschen durch die Viren profitiert. Vor allem bei Kleinkindern ist dieses Bakterium auch Erreger von Hirnhautentzündungen (Meningitis) und weiteren entzündlichen Erkrankungen. Als Prophylaxe wird eine Schutzimpfung gegen H. influenzae Typ b (HIB-Impfung) empfohlen. Weltweit sterben jährlich geschätzt 371.000 Kinder unter 5 Jahren an dieser impfpräventablen Infektion.[1]
Bekapselt ist H. influenzae obligat pathogen. Davon abzugrenzen ist die unbekapselte Bakterien-Variante, die einen Teil der Normalflora des Menschen darstellt. Sie ist nur unter bestimmten Umständen, z. B. bei Epithelvorschädigung durch Giftstoffe wie Nikotin pathogen (krankheitsauslösend). Der Nachweis erfolgt aus Sputum, Blut und Liquor per kultureller Anzucht. Idealerweise erfolgt diese auf Kochblutagar. Die oft zusätzlich verwendete „Amme“ Staphylococcus aureus schafft dabei durch starke NAD-Produktion ideale Wachstumsbedingungen. Nach 1- bis 2-tägiger Inkubation bei 37 °C lassen sich glatte, leicht durchsichtige Kolonien feststellen.
Haemophilus ducreyi
Haemophilus ducreyi ist als Streptobacillus des Weichen Schankers (auch Ulcus molle) bekannt und ist der Erreger dieser meldepflichtigen Geschlechtskrankheit. Die Krankheit und damit auch ihr Erreger kommen vor allem in den tropischen (und armen) Regionen in Afrika, Südostasien und Lateinamerika vor. Sichtbares Symptome sind rundliche Geschwüre an den Schamlippen und im Scheidenvorhof der Frau bzw. an der Eichel und am Penisschaft des Mannes. Seit 2003 ist auch das Genom dieses Bakteriums bekannt.
Haemophilus aegyptius
Haemophilus aegyptius, auch als Koch-Weeks-Bacillus bezeichnet, ist morphologisch nicht von H. influenzae zu unterscheiden. Er ist vor allem in Nordafrika und anderen tropischen und subtropischen Kontinenten verbreitet und ist der Erreger der als purulente Konjunktivitis bekannten Augenbindehautentzündung.
Haemophilus parainfluenzae
Haemophilus parainfluenzae tritt nur sehr selten als Krankheitserreger einer Form der Endokarditis (entzündliche Veränderung der Herzinnenhaut) auf.
Haemophilus vaginalis
Hierbei handelt es sich um eine alte Bezeichnung der jetzt als Gardnerella vaginalis benannten Bakterien, die ziemlich häufig bei unspezifischen Entzündungen der Vagina und der Gebärmutter auftreten. Das Bakterium ist allerdings wahrscheinlich nicht immer pathogen, da es auch bei gesunden Frauen häufig festgestellt wird.
Haemophilus haemolyticus
Anders als die anderen Vertreter der Gattung ist Haemophilus haemolyticus in der Lage, das Hämoglobin des Blutes zu spalten und zu nutzen. Eine Rolle als Krankheitserreger ist für diese Art jedoch nicht bekannt.
Haemophilus parasuis
Erreger der Glässerschen Krankheit der Schweine. Fieberhafte Polyserositiden und Polyarthritiden dominieren das Krankheitsbild. Der Erreger wird aber auch auf den Schleimhäuten nicht erkrankter Tiere nachgewiesen. Zu ausgeprägten Krankheitsbildern kommt es meist unter Stresseinfluss. Der kulturelle Erregernachweis gelingt besonders gut aus dem Liquor cerebrospinalis unter Berücksichtigung artspezifischer Wachstumsansprüche.
Haemophilus paragallinarum
Erreger des Ansteckenden Hühnerschnupfen (Coryza contagiosa). Auffälligstes klinisches Symptom ist der „Eulenkopf“, der auf Sekretstau in den Nasennebenhöhlen zurückzuführen ist.
Ehemalige Vertreter
Haemophilus somnus galt taxonomisch für die Einteilung in die Gattung Haemophilus als fragwürdig. Nach Bergey´s Manual gehört er zu den species incertae sedis. Die Unabhängigkeit sowohl vom X- als auch vom V-Faktor widerspricht allerdings der Einordnung in die Gattung Haemophilus. Die als Haemophilus agni und Histophilus ovis beschriebenen Bakterien wurden deshalb mit H. somnus in der neuen Art Histophilus somni zusammengefasst. Er ist der Erreger der ISTME (Infektiöse, septikämische, thrombosierende Meningoencephalitis) des Rindes. Symptome sind fieberhafte Allgemeinerkrankungen mit zentralnervösen Erscheinungen. Des Weiteren kann der Erreger an Endometriden, Mastitiden, Aborten und der Geburt lebensschwacher Kälber beteiligt sein.
Therapie
Therapie der Wahl sind die Antibiotika Amoxicillin oder Moxifloxacin.
Einzelnachweise
- ↑ Watt et.al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years: global estimates. The Lancet, Volume 374, Issue 9693, Pages 903 - 911. doi:10.1016/S0140-6736(09)61203-4
Literatur
- Stichwörter „Haemophilus“, „Haemophilus“, „Haemophilus aegypticus“, „Haemophilus ducreyi“, „Haemophilus haemolyticus“, „Haemophilus influenzae“, „Haemophilus parainfluenzae“, „Haemophilus vaginalis“ in Pschyrembel Medizinisches Wörterbuch. 257. Auflage, Walter de Gruyter, Berlin 1993; Seite 588
- Medizinische Mikrobiologie, Infektions- und Seuchenlehre, Rolle/Mayr, 8. Auflage, 2006
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Klebsiella
Die Gattung Klebsiella umfasst gramnegative Stäbchenbakterien der Familie der Enterobacteriaceae. Benannt wurden sie nach dem ostpreußischen Bakteriologen Edwin Klebs, geboren 1834 in Königsberg (Preußen) und gestorben 1913 in Bern. Die Bakterien haben keine aktive Bewegung und sind von einer Schleimkapsel umgeben. Sie leben unter oxischen Bedingungen, also in Gegenwart von Sauerstoff, aerob, können aber auch ohne Sauerstoff leben, d. h. sie sind fakultativ anaerob. Typisch für Klebsiella ist ein schmieriger Film, der auf den Kolonien entsteht.
Klebsiella-Arten leben im Boden, in Gewässern und auf Getreide. Von den Klebsiella-Arten sind Klebsiella pneumoniae als Bewohner des Magen-Darm-Traktes, sowie Klebsiella granulomatis als Erreger des Granuloma inguinale medizinisch relevant. Alle Arten sind unempfindlich gegen Penicillin.
Stoffwechsel
Die Angehörigen der Gattung Klebsiella sind chemoorganotroph, d. h. sie bauen zur Energiegewinnung organische Stoffe ab. Sie sind fakultativ anaerob: Wenn Sauerstoff vorhanden ist (oxisches Milieu), haben sie einen oxidativen Energiestoffwechsel, sie oxidieren die organischen Stoffe zu Kohlenstoffdioxid (CO2) und Wasser; wenn kein Sauerstoff vorhanden ist, also unter anoxischen Bedingungen, nutzen sie die 2,3-Butandiolgärung zur Energiegewinnung. Hierbei entstehen als Endprodukt vor allem in großen Mengen der Alkohol 2,3-Butandiol und CO2, daneben in geringen Mengen u. a. verschiedene Säuren.
Bei anderen Gattungen der Familie Enterobacteriaceae wie z. B. Escherichia und Salmonella, ist die Gemischte Säuregärung der anaerobe Energiestoffwechselweg, wobei im Gegenteil zu der Butandiolgärung große Mengen von Säuren (Essigsäure, Milchsäure und Bernsteinsäure) als Endprodukte entstehen, aber kein Butandiol. Dieses Merkmal wird zur Unterscheidung der Enterobacteriaceae-Gattungen genutzt. Dazu dient der Voges-Proskauer-Test, mit dem Acetoin, ein Zwischenprodukt der 2,3-Butandiolgärung, nachgewiesen wird. Klebsiella reagiert hierbei also positiv.
Arten
- Klebsiella pneumoniae (Schroeter 1886) Trevisan 1887
- Klebsiella pneumoniae subsp. pneumoniae (Schroeter 1886) Ørskov 1984
- Klebsiella pneumoniae subsp. ozaenae (Abel 1893) Ørskov 1984
- Klebsiella pneumoniae subsp. rhinoscleromatis (Trevisan 1887) Ørskov 1984
- Klebsiella oxytoca (Flügge 1886) Lautrop 1956
- Klebsiella mobilis Bascomb et al. 1971
- Klebsiella singaporensis Li et al. 2004
- Klebsiella granulomatis (Aragão and Vianna 1913) Carter et al. 1999
- Klebsiella variicola Rosenblueth et al. 2004
Synonyme (Auswahl)
- K. ozeanae (Abel 1893) Bergey et al. 1925 : Jetzt als Unterart Klebsiella pneumoniae subsp. ozeanae geführt
- K. rhinoscleromatis Trevisan 1887 : Nun ebenfalls als Unterart zu K. pneumoniae gestellt
- Calymmatobacterium granulomatis Aragão and Vianna 1913: jetzt als K. granulomatis zu der Gattung gestellt. Andere Synonyme: Encapsulatus inguinalis (Bergey 1923), Donovania granulomatis (Anderson et al. 1944).
- Enterobacter aerogenes und Klebsiella mobilis: Beide Namen sind innerhalb der Taxonomie formal gültig (ein homotypisches Synonym). Der nicht formal gültige Name Klebsiella aerogenes wird teilweise, in Bezug auf die Umstellung von Enterobacter aerogenes zu Klebsiella, ebenfalls für diese Art genutzt.
Folgende Arten wurden zu der Gattung Raoultella gestellt:
- Klebsiella terrigena Izard et al. 1981
- Klebsiella ornithinolytica Sakazaki et al. 1989
- Klebsiella planticola Bagley et al. 1925 (Synonym K. trevisanii Ferragut et al.)
Quellen
Systematik und Synonyme nach:
- George M. Garrity, Julia A. Bell, Timothy G. Lilburn: Taxonomic Outline of the Prokaryotes. Bergey's Manual of Systematic Bacteriology. Second Edition, Release 5.0, Springer-Verlag, New York, 2004. DOI http://xxx
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes, A Handbook of the Biology of Bacteria. 7 Bände, 3. Auflage, Springer-Verlag, New York u. a. O., 2006, ISBN 0-387-30740-0. Vol. 6: Proteobacteria: Gamma Subclass, ISBN 0-387-30746-X
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Proteus (Bakterien)
Proteus ist eine Gattung gramnegativer Proteobacteria. Sie ist nach dem griechischen Meeresgott Proteus benannt, der in der Odyssee Homers als äußerlich höchst wandelbar charakterisiert wird.
Merkmale
Die Gattung Proteus ist den Gattungen Providencia und Morganella sehr ähnlich. Alle drei Gattungen produzieren Phenylalanin-Deaminase aber keine Arginin-Decarboxylase, können kein Malonat verstoffwechseln und zeigen keine Säureproduktion bei Dulcitol, D-Sorbitol und L-Arabinose-Verstoffwechselung. Proteus ist zudem charakterisiert durch die Fähigkeit zur Gelatine-Verflüssigung, Schwefelwasserstoff-Produktion, Harnstoff-Lyse (Urease) und zur Spaltung von Maisölfetten. Zudem zeigt Proteus ein deutliches Schwärmverhalten.
Medizinische Bedeutung
Proteus-Bakterien sind Teil der normalen Darmflora des Menschen, einige Vertreter können allerdings auch verschiedene Erkrankungen auslösen, darunter Zystitis, Durchfall, Nierenbeckenentzündung und Prostatitis. Proteus-Infektionen treten dabei relativ häufig nosokomial auf.
Systematik
Derzeit sind fünf benannte Arten sowie eine Reihe von unbenannten Genotypen bekannt. Die benannten Arten sind:
- Proteus hauseri
- Proteus mirabilis
- Proteus myxofaciens
- Proteus penneri
- Proteus vulgaris
Proteus vulgaris
Proteus vulgaris ist ein stäbchenförmiges, gramnegatives Bakterium; das den Darmtrakt der Menschen und der Tiere bewohnt. Es kann im Boden, im Wasser und im fäkalen Milieu gefunden werden. Es zählt zu den Enterobacteriaceae und ist ein opportunistischer Krankheitserreger der Menschen. Es ist bekannt dafür, Infektionen des Urinaltrakts und Wundinfektionen zu verursachen.
Der erste Verwendung des Begriffs „Proteus“ in der bakteriologischen Nomenklatur stammt von Hauser (1885), der drei Typen dieser Organismen beschrieb, die er aus verfaultem Fleisch isolierte. Eine der drei war Proteus vulgaris, dieser Organismus hat also eine lange Geschichte in der Mikrobiologie. In die letzten zwei Jahrzehnten hat die Klasse Proteus, insbesondere Proteus vulgaris, einige Änderungen in der Taxonomie durchgemacht. 1982 wurde Proteus vulgaris in drei Gruppen auf der Grundlage der Indolproduktion getrennt. Die erste Gruppe war indolnegativ und stellte eine neue Art dar (Proteus penneri), während die zweite und dritte Gruppe zusammen neu als Proteus vulgaris verblieb.
Wirksame Antibiotika
- Proteus mirabilis, häufiger Erreger von Harnwegsinfektionen, ist in der Regel gegenüber Ampicillin und Cefazolin empfindlich.[1]
- Proteus vulgaris, der gelegentlich als Sekundärkeim auf nekrotischem Gewebe vorkommt, bildet β-Lactamasen und ist daher unempfindlich gegen die Amino-Penicilline und die Cephalosporine der 1. Generation. Cefotaxim, Ceftriaxon und die Carbapeneme sind jedoch meistens wirksam. Außerdem können β-Lactamase-Inhibitoren zum Einsatz kommen.
Proteus-Arten reagieren empfindlich auf Chinolone und Breitspektrum-Cephalosporine der 3. Generation. Zur Therapie der unkomplizierten Harnwegsinfektion mit Proteus-Arten wird auch gelegentlich Cotrimoxazol empfohlen.[2]
Einzelnachweise
- ↑ Wolfgang Stille, Hans-Reinhard Brodt, Andreas H Groll, Gudrun Just-Nübling: Antibiotika-Therapie: Klinik und Praxis der antiinfektiösen Behandlung, Schattauer Verlag, 2005, ISBN 3-7945-2160-9, S.403-404
- ↑ Zeitschrift für Chemotherapie [1]
Quellen
- O'Hara, C.M., Brenner, F.W., Miller, J.M.: Classification, Identification, and Clinical Significance of Proteus, Providencia, and Morganella. In: Clinical Microbiology Reviews. Nr. 13(4), 2000, S. 534-546. [2]
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Pseudomonas aeruginosa
Pseudomonas aeruginosa (von lat. aerugo Grünspan) ist ein gramnegatives, oxidasepositives Stäbchen der Gattung Pseudomonas. Es wurde im Jahr 1900 von Walter Migula entdeckt. Die Namensgebung bezieht sich dabei auf die blau-grüne Färbung des Eiters bei eitrigen Infektionskrankheiten. Im Jahre 2000 wurde erstmals das komplette Genom des Stammes PAO1 sequenziert. Das Genom hat eine Größe von 6,3 Mbp und enthält 5570 Gene [1].
Vorkommen
Das Bakterium ist ein weitverbreiteter Boden- und Wasserkeim (Nasskeim), der in feuchten Milieus vorkommt (neben feuchten Böden und Oberflächengewässern auch in Leitungswasser, Waschbecken, Duschen, Toiletten, Spülmaschinen, Dialysegeräten, Medikamenten und Desinfektionsmitteln). In der Hygiene gilt es daher als bedeutender Krankenhauskeim (nosokomialer Keim). Aber auch als Lebensmittelverderber spielt es eine erhebliche Rolle, was Isolate aus Pflanzen, Früchten, Lebensmitteln und dem Darmtrakt von Mensch und Tier belegen. Es kann selbst in destilliertem Wasser oder einigen Desinfektionsmitteln überleben und wachsen, wenn kleinste Spuren von organischen Substanzen vorhanden sind.
Aussehen
Das Stäbchen kann 2–4 µm groß werden und besitzt büschelige lophotriche Flagellen. Haftfimbrien ermöglichen es dem Bakterium sich an Oberflächen festzusetzen. Auf der äußeren Zellmembran ist ein Exopolysaccharid (Alginat) wie eine Kapsel aufgelagert. Es schützt vor Phagozyten und Antikörpern und wirkt dem Transport aus dem Respirationstrakt entgegen.
Stoffwechsel
P. aeruginosa ist nicht zur Gärung befähigt und kann daher aerob existieren. In seltenen Fällen stellt es aber auch auf eine anaerobe Lebensweise um (siehe Mukoviszidose). P. aeruginosa wird daher auch den Nonfermentern zugeordnet. In verschiedenen Nährmedien (z. B. Cetrimid-Agar) setzt es Farbstoffe wie Pyocyanin, Pyoverdin (= Fluorescein), Pyorubin und Pyomelanin frei. Meist ist es auf Agar „metallisch-grün“ glänzend. Charakteristisch ist dabei „lindenblütenartiger“ süßlicher Geruch („Gummibärchengeruch“).
Neuere Forschungsergebnisse zeigen auf, dass P. aeruginosa mit Hilfe des Verdauungsenzyms SdsA sogar Natriumlaurylsulfat (SDS) verstoffwechseln kann. Dadurch ist das Bakterium in der Lage, auch dort zu überleben, wo andere Bakterien aufgrund der hohen SDS-Konzentration abgetötet werden, beispielsweise in Shampoos.[2]
P. aeruginosa produziert unter limitierenden Wachstumsbedingungen (z.B. Stickstoff-, Phosphat- oder Eisenlimitierung) auf Ölen (z.B. Sonnenblumenöl) aus nachwachsenden Rohstoffen sog. Rhamnolipide. Diese sind Biotenside und werden teilweise schon im Produktionsmaßstab hergestellt und gelangen als Tenside in Waschmittel oder Kosmetika. Vermutlich geben die Zellen die Rhamnolipide in das sie umgebende Medium um das Öl zu emulgieren und mittels Lipasen an den Wasser/Öl-Grenzflächen das Öl in Fettsäuren und Glycerid zu spalten. Die Rhamnolipidsynthese ist Quorum sensing reguliert, hängt also von der Zelldichte im Medium ab. Zuständig hierfür sind das Las- und Rhl-regulierte Quorum sensing.[3]
Pathogenität
Das Bakterium ist ein Krankenhauskeim, der durch seinen Stoffwechsel und seine Zellmembranstruktur Mehrfachresistenzen gegenüber Antibiotika aufweist.[4] Mit ca. 10 % aller Krankenhausinfektionen gehört P. aeruginosa zu den in Deutschland am häufigsten auftretenden Krankenhauskeimen.[5] Das Spektrum an Krankheiten, welche durch diese Bakterien verursacht werden, ist umfangreich. Auslöser dafür sind zum einen die Fähigkeit zur Hämolyse und zum anderen Pathogenitätsfaktoren wie das Exotoxin A (ADP-Ribosyltransferase) sowie die Cytotoxine Exoenzym S und Exoenzym U, die das Bakterium produziert. Das häufigste Erscheinungsbild sind Pneumonien bei zystischer Fibrose, die vor allem bei immunsupprimierten und AIDS-Patienten besonders schwerwiegend sind. Harnwegsinfekte, Enterokolitis, Meningitis, Otitis externa („swimmer’s ear“) oder Infektionen auf Brandwunden können ebenfalls ausgelöst werden.
Veterinärmedizin
Im Folgenden werden die häufigsten tiermedizinischen Befunde aufgelistet:
- Entzündung des äußeren Gehörgangs beim Hund
- Eiterungen und Abszesse der Haut bei vielen Tierarten
- Darmentzündungen
- Euterentzündungen bei Kühen
- Scheidenentzündungen, Gebärmutterentzündung und Aborte bei Kühen und Stuten
- Traumatische Herzbeutelentzündung beim Rind
- Allgemeininfektion beim Geflügel
- Geschwürige Hornhautentzündung und Bindehautentzündung beim Pferd
- Eitrig-nekrotisierende Lungenentzündungen
- Blutende Lungenentzündung beim Nerz
- Maulschleimhautentzündungen, Abszesse und Allgemeininfektionen bei Reptilien
Therapie
- β-Lactam-Antibiotika (z. B. Piperacillin) + Aminoglykoside (Gentamicin, Tobramycin)
- Cephalosporine der Generation IIIb (höhere Wirksamkeit gegen Pseudomonas spp. als Generation IIIa) (z. B. Ceftazidim, Cefepim)
- Gyrasehemmer wie Ciprofloxacin oder Levofloxacin
- Carbapeneme als Reserveantibiotika (z. B. Imipenem oder Meropenem)
- So kämpft Pseudomonas aeruginosa gegen Konkurrenten
Einzelnachweise
- ↑ Stover, CK et al. (2000): Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen In: Nature Bd. 406(6799), S. 947-8 , PMID 10984043
- ↑ Hagelüken, Gregor et al. (2006): The crystal structure of SdsA1, an alkylsulfatase from Pseudomonas aeruginosa, defines a third class of sulfatases In: PNAS, Bd. 103, S. 7631-7636 PMID 16684886 doi:10.1073/pnas.0510501103
- ↑ F. Leitermann: Biotechnologische Herstellung mikrobieller Rhamnolipide. Karlsruhe 2008, Universität Karlsruhe (TH)
- ↑ Kozlova, E. V., L. A. Anisimova, et al. (1989): [Antibiotic resistance in clinical strains of Pseudomonas aeruginosa isolated from 1979-1984]. In: Antibiot Khimioter 34(1): 24-8. PMID 2499281
- ↑ Zeitschrift für Chemotherapie 3-2008
Literatur
- Medizinische Mikrobiologie, Infektions- und Seuchenlehre von Rolle/Mayr, Enke Verlag, Stuttgart 2007
- Frank Dara: Research topic on Pseudomonas aeruginosa, Biology, Genetics, and Host-Pathogen Interactions. In: Frontiers in Microbiology 2(2012) (Editorial)
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Serratia
Bei Bakterien der Gattung Serratia handelt es sich um eine Gruppe gram-negativer Stäbchenbakterien aus der Familie der Enterobakterien (Enterobacteriaceae).
Die Gattung Serratia umfasst 12 verschiedene Arten, wobei der häufigste Vertreter S. marcescens ist, dessen bedeutendes Merkmal seine rote Pigmentation ist.
Der bevorzuge Lebensraum der Serratia-Arten ist die Umgebung der Darmflora. Als Krankheitserreger spielen die Bakterien nur selten eine Rolle, jedoch steigt die Frequenz der nosokomialen Infektionen (Pneumonie, Wundinfektion) auf Kinderabteilungen und Intensivstationen.
Arten
- S. entomophila Grimont et al. 1988
- S. ficaria Grimont et al. 1981
- S. fonticola Gavini et al. 1979
- S. grimesii Grimont et al. 1983
- S. liquefaciens (Grimes & Hennerty 1931) Bascomb et al. 1971
- S. marcescens Bizio 1823
- S. odorifera Grimont et al. 1978
- S. plymuthica (Lehmann & Neumann 1896) Breed et al. 1948
- S. proteamaculans (Paine & Stansfield 1919) Grimont et al. 1978
- S. quinivorans (Grimont et al. 1983) Ashelford et al. 2002
- S. rubidaea (Stapp 1940) Ewing et al. 1973
- S. ureilytica Bhadra et al. 2005
Quellen
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes, A Handbook of the Biology of Bacteria. 3. Auflage. Vol. 6: Proteobacteria: Gamma subclass. Springer-Verlag, New York u. a. O. 2006, ISBN 978-0-387-25496-8.
- Serratia Bizio, 1823 im NCBI Taxonomy Browser
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Staphylococcus aureus
(Weitergeleitet von Staphylokokkus aureus)
Staphylococcus aureus ist ein kugelförmiges, Gram-positives Bakterium, das häufig in Traubenform angeordnet ist (Haufenkokken). Staphylokokken sind unbeweglich und bilden keine Sporen. Die Größe des Bakteriums liegt üblicherweise zwischen 0,8 und 1,2 µm. S. aureus kommt fast überall in der Natur, auch auf der Haut und in den oberen Atemwegen von 25 bis 30 % aller Menschen vor. Meist löst es keine Krankheitssymptome aus. Man spricht in diesem Falle von einer klinisch asymptomatischen Besiedlung oder Kolonisation der Person mit dem pathogenen Bakterium („Kolonisationskeim“). Bekommt das Bakterium durch günstige Bedingungen oder ein schwaches Immunsystem die Gelegenheit, sich auszubreiten, kommt es beim Menschen zu Hautinfektionen (Furunkel, Karbunkel), Muskelerkrankungen (Pyomyositis), in ungünstigen Fällen auch zu lebensbedrohlichen Erkrankungen wie Lungenentzündung, Endokarditis, Toxisches Schock-Syndrom (TSS) und Sepsis. Falls diese Bakterien Resistenzen gegen mehrere wichtige Antibiotika erwerben (Multiresistenz), sind sie besonders schwer zu eliminieren und werden bei Übertragung auf Dritte auch für diese zur Gefahr. Bei Tieren ist S. aureus einer der wichtigsten Verursacher von Mastitis.
Name
Die Bezeichnung Staphylococcus aureus besteht aus einem latinisierten Singular zweier altgriechischer Bestandteile, nämlich σταφυλή staphylé ‚Weintraube‘ und κόκκος kókkos ‚Kern‘, ‚Korn‘[1], sowie dem lateinischen aureus ‚der goldene‘. Die Farbbezeichnung rührt daher, dass die meisten Stämme von S. aureus orangegelb („goldgelb“) gefärbt sind (seine Kolonien auf Agargelplatten sind so gefärbt) und dass S. aureus lange Zeit als der Erreger des sog. „goldgelben“ Eiters galt.
Pathomechanismen
Staphylococcus aureus besitzt zahlreiche Pathogenitätsfaktoren, darunter eine Polysaccharidkapsel mit Protein A, die das Bakterium vor Aufnahme in Makrophagen (Phagozytose) schützt. Das Protein A bindet Antikörper an deren Fc-Fragment, also genau „verkehrt herum“, als es für eine effektive Opsonierung notwendig wäre. Dadurch erkennen Makrophagen den Fc-Teil nicht und eine Aufnahme und Zerstörung unterbleibt. Staphylococcus aureus ist ein fakultativ intrazellulärer Erreger und kann mittels Fibronektin bindender Proteine indirekt an Integrin α5β1 binden und über einen Zipper-Mechanismus in die Wirtszelle eindringen. Dies ist einerseits wichtig für die Erregerpersistenz als auch bei der Entstehung invasiver Krankheitsbilder wie Endokarditis, Sepsis und Mastitis[2].
Die Koagulase und der Clumping-Faktor A bewirken eine lokale Gerinnung von Fibrin und damit die Ausbildung eines Fibrinwalls, mit dem S. aureus sich umkleidet und von Antikörpern nun nicht mehr erkannt wird. Der Clumping Faktor ist ein auf der Zelloberfläche befindlicher Fibronektinrezeptor. Erst wenn sich das Bakterium stark vermehrt hat, wird mit Hilfe von Staphylokinase Fibrinolysin gebildet und der Wall aufgebrochen. Mittels der bakteriellen Enzyme Hyaluronidase, DNase, Lipase und Hämolysin ist es nun im Stande, interzelluläres Bindegewebe und Parenchymzellen zu lysieren und invasiv in den Wirtsorganismus vorzudringen. Leukocidin hilft dabei, die zellulären Bestandteile der Immunantwort (Granulozyten und Makrophagen) zu schädigen. Auf diesem Wege verursacht S. aureus pyogene (eitrige) Infektionen, die lokal-oberflächlich (beispielsweise Furunkel, Karbunkel) auftreten können, aber auch schwere tiefe, systemische Prozesse (Osteomyelitis, Pneumonie, Endokarditis, Abszesse, Empyeme, Sepsis) mit hoher Letalität bedingen können.
Die Koagulase und der Clumping Faktor werden zum Nachweis von S. aureus herangezogen.
S. aureus kann mehrere Toxine produzieren, die zu verschiedenen typischen Erkrankungen führen:
- Enterotoxine sind Superantigene. Da sie sehr hitzebeständig sind und durch Kochen nicht zerstört werden, spielen sie eine große Rolle bei Lebensmittelvergiftungen (Durchfall, Erbrechen mit kurzer Inkubationszeit von wenigen Stunden).
- Exfoliatine A und B (in etwa 5 % der S. aureus-Isolate vorhanden) sind neben der Invasion der Bakterien beteiligt am Staphylococcal Scalded Skin Syndrome (Morbus Ritter von Rittershain, Pemphigus neonatorum oder Syndrom der verbrühten Haut: Blasenbildung im Bereich der Haut, Rötung, Juckreiz, Lethargie, Fieber oder Hypothermie, Schleimhäute nicht mitbetroffen (im Gegensatz zum Lyell-Syndrom), Blasen ohne Erreger, hauptsächlich bei Kleinkindern und immunsupprimierten Erwachsenen über 60 Jahre, Therapie: symptomatisch: Flüssigkeit, Haut wie bei Brandverletzten (ITS), Clindamycin als Antibiotikum der Wahl)
- Impetigo bullosa: Blasenbildung nur am Ort der Infektion, bei immunkompetenten Patienten mit Antikörpern gegen Exfoliatine
- TSS: Toxic Shock Syndrome (klassisch bei Tampon benutzenden Frauen aufgetreten, da das Toxin nur bei Magnesiummangel produziert wird. Heutige Tampons sind sicher. Toxin wirkt als Superantigen und aktiviert viele T-Zellen gleichzeitig: Hautrötung, Fieber, Schock usw.)
- Panton-Valentine-Leukocidin: Nekrotisierende Pneumonien mit hoher Letalität.[3]
Staphylococcus aureus zählt zu den wichtigsten Erregern im Krankenhaus erworbener (nosokomialer) Infektionen. Der Erreger kann jedoch auch über Haut oder Schleimhaut von Mensch und Tier aufgenommen werden. Durch Husten oder Niesen besteht die Möglichkeit der Übertragung auf Lebensmittel.
Das Bakterium ist äußerst widerstandsfähig gegen Austrocknung und kann zusätzlich eine Reihe von Resistenzen gegenüber Antibiotika aufweisen.
Multiresistenz
Gebräuchliche Abkürzungen:
- MRSA = Methicillin-resistenter Staphylococcus aureus
- MRE = Multi-resistente Erreger
- ORSA = Oxacillin-resistenter Staphylococcus aureus
- VISA = Vancomycin-intermediate Staphylococcus aureus
- VRSA = Vancomycin-resistenter Staphylococcus aureus
- aber auch
- MRSA = Multi-resistenter Staphylococcus aureus[4]
Unter MRSA (gleichbedeutend auch als ORSA bezeichnet) versteht man im engeren Sinne Staphylococcus aureus-Stämme, die gegen alle bisher marktverfügbaren β-Lactam-Antibiotika (z. B. Penicillin) resistent sind. Sie sind allerdings in der Regel multiresistent, verfügen also meist auch über Resistenzen gegenüber anderen Antibiotikaklassen, so gegen Chinolone, Tetracycline, Aminoglykoside, Erythromycin, Sulfonamide. Daher gilt MRSA vereinfachend als Sammelbezeichnung für alle Antibiotika-resistenten SA-Stämme. VRSA besitzen zusätzlich eine verminderte Empfindlichkeit gegenüber Vancomycin und anderen Glykopeptidantibiotika. Die wenigen bisher beschriebenen VRSA-Stämme sind resistent gegenüber Vancomycin und anderen Glykopeptidantibiotika.
Methicillin wurde historisch für den Antibiotika-Sensitivitätstest von Bakterien eingesetzt. Eine Therapie erfolgt im positiven Fall meist mit Vancomycin, solange keine Resistenzen gegen dieses Arzneimittel vorliegen. Die Behandlung sollte sich am Antibiogramm orientieren, denn auch gegen Vancomycin sind schon Resistenzen aufgetreten (VRSA).
Methicillin und Oxacillin gehören zu den Penicillinase-stabilen Penicillinen. In Deutschland wird unter anderem Oxacillin eingesetzt. Weitere Vertreter dieser Stoffklasse sind Cloxacillin, Dicloxacillin und Nafcillin (in den USA verwendet). Methicillin wird nicht mehr zur Therapie verwendet.
Erstmals beschrieben wurden MRSA Anfang der 1960er Jahre in Großbritannien.[5][6]
In Deutschland bekannt wurden sie auch durch den Fernseh-Dokumentarfilm „Tatort Krankenhaus“ von Tilman Wolff. Darin wurde 2008 verdeutlicht, dass in deutschen Krankenhäusern jährlich etwa 160.000 Menschen mit MRSA infiziert werden und dass es im Klinikalltag vielfach an elementaren Hygienemaßnahmen wie Händewaschen mangelt.[7]
2011 wurden in einer Studie in den USA in Geflügelfleisch Erreger nachgewiesen, die gegen neun Antibiotika resistent sind.[8][9]
Mechanismus der Resistenz
Gegen Antibiotika resistente Erreger kommen vermehrt dort vor, wo ständig Antibiotika verwendet werden. Die Antibiotika töten zwar fast alle Individuen der Erreger ab, aber einige wenige können überleben, weil sie aufgrund einer Mutation gegen das angewendete Antibiotikum resistent sind. Diese resistenten Individuen vermehren sich dann trotz der Antibiotika-Therapie weiter – eine klassische Selektion im evolutionsbiologischen Sinne. Die Resistenz vermittelnden Gene werden dabei auch artübergreifend weitergegeben, zum Beispiel von Staphylococcus aureus zu anderen Arten.[10] Die Entstehung von Resistenzen gegen Antibiotika wird allerdings auch durch die Verwendung von Reinigungsmitteln, die sogenannte quartäre Ammoniumverbindungen (QAV) mit desinfizierender Wirkung enthalten, begünstigt. Denn dieselben Gene der Bakterien, welche die QAV-Resistenz liefern, vermitteln ihnen auch die Resistenz gegen Antibiotika.[10] Zu den insofern kritischen Stoffen gehören die meisten marktüblichen kationischen Tenside. Ähnliches gilt für Triclosan, das als Desinfektions- und Konservierungsstoff in Haushaltsreinigern, Waschmitteln, Zahnpasten, Deodorantien und Seifen enthalten ist.
MRSA besitzen das Resistenzgen mecA, das für ein modifiziertes Penicillin-Bindeprotein (PBP2a, syn. PBB2') kodiert. Dieses Protein – die bakterielle Transpeptidase – ist normalerweise für die korrekte Verknüpfung der Bausteine der Zellwand verantwortlich. β-Lactam-Antibiotika imitieren einen solchen Baustein, binden aber irreversibel an die Transpeptidase welche dadurch dauerhaft inaktiviert wird. Wenn genügend Transpeptidasen auf diese Weise zerstört werden, können keine neuen Verknüpfungen mehr gebildet werden und die Zellwandsynthese kommt zum Erliegen. (β-Lactam-Antibiotika wirken deshalb nur auf wachsende Zellen.)
β-Lactam-Antibiotika können an das modifizierte Penicillin-Bindeprotein nicht mehr binden, dieses kann ungehindert weiter bei der Zellwandsynthese helfen. Das führt dazu, dass MRSA gegen alle β-Lactam-Antibiotika (Penicilline, Cephalosporine und Carbapeneme) resistent sind. Charakteristisch für MRSA war bis vor kurzem, dass sie auch gegen weitere Antibiotikaklassen (beispielsweise Tetracycline, Aminoglykoside, Makrolide) Resistenzen erworben haben und damit eine Multiresistenz aufweisen. Seit wenigen Jahren beobachtet man zusätzlich eine neue Gruppe von MRSA, die diese Multiresistenz nicht aufweisen und als sog. community-acquired MRSA (auch community onset MRSA) bezeichnet werden.
Ein weiterer Resistenzmechanismus gegen β-Lactame, der aber nicht nur bei den MRSA anzutreffen ist, beruht auf der Bildung eines Enzyms, das Penicillin abbauen kann (Betalactamase).
Allerdings sind auch Infektionen mit nicht resistenten Staphylococcus-Stämmen, etwa im Mittelohr oder in den Atemwegen, häufig nur sehr schwer mit Antibiotika zu bekämpfen. Diese Infektionen neigen dazu, chronisch zu werden, das heißt, sie flammen immer wieder auf. Offenbar sind diese Bakterien in der Lage, in Körperzellen einzudringen.[11] Dort fahren die Krankheitserreger ihren Stoffwechsel stark herunter. Durch den Einschluss in Körperzellen dem Immunsystem des Wirts entzogen und durch Absenkung des Stoffwechsels geschützt vor Antibiotika können sie so Tage bis möglicherweise Wochen ausharren, um anschließend ihren Stoffwechsel wieder hochzufahren, sich zu vermehren und sich erneut auszubreiten.
Verbreitung von MRSA
Auffallend sind die großen Unterschiede in der Häufigkeit von MRSA zwischen Staaten ansonsten gleichen Niveaus des Gesundheitswesens.[12] Während in den skandinavischen Ländern der Anteil von MRSA unter den S. aureus-Stämmen gering ist und in den Niederlanden bei ca. 3 % liegt, beträgt die MRSA-Rate im benachbarten Deutschland durchschnittlich etwa 25 %,[13] wobei es – vermutlich je nach Krankenhaushygiene – starke lokale Unterschiede gibt (bis über 50 %). In den südeuropäischen Ländern, den USA sowie in vielen asiatischen Ländern (Japan) liegen die Werte sogar bei 30 bis über 70 %. Auch in Gefängnissen, ambulanten Diensten, öffentlichen Duschen und dergleichen finden sich MRSA.
In Einrichtungen der Alten- und Krankenversorgung
MRSA stellen weltweit vor allem in Kliniken eine Gefahr dar. Besonders betroffen sind die chirurgischen Intensivstationen, Abteilungen für Brandverletzungen und Neugeborenenstationen.
Der Anteil von Personen mit MRSA zu nicht betroffenen Personen (Prävalenz) bei Bewohnern von Altenheimen und Patienten von Reha- und Akutkliniken lag im Kreis Höxter zwischen 1,2 und 3,4 %.[14] In Deutschland infizieren sich etwa 50.000 Patienten je Jahr mit MRSA. In manchen Kliniken beruhen bis zu 30 % der dort erworbenen Infektionen auf MRSA.
Eine unbekannte Anzahl von Patienten ist schon bei der Aufnahme in die Klinik infiziert, ohne es zu wissen. Hier kann nur eine Eingangsuntersuchung Klarheit verschaffen, wie sie in den Niederlanden durchgeführt wird.
Nach Angaben der Techniker-Krankenkasse Schleswig-Holstein ist die Zahl der MRSA-Erkrankungen in den Kliniken dieses Bundeslandes von 2006 bis 2009 um 192 % gestiegen (von 191 auf 557 Fälle). Auch die Zunahme in anderen Bundesländern lag bei teilweise über 200 %.[15]
Außerhalb von Kliniken
Zum ersten Mal beschrieben wurden Methicillin-resistente S. aureus-Stämme 1993 bei australischen Ureinwohnern, die nie Kontakt zum Gesundheitswesen hatten.[16] Ende der neunziger Jahre des 20. Jahrhunderts wurden solche Stämme zum ersten Mal in den USA beobachtet. Seither haben ambulant erworbene MRSA-Infektionen stetig an Bedeutung gewonnen.
MRSA werden zunehmend auch außerhalb von Krankenhäusern gefunden. Im englischsprachigen Schriftgut werden diese Erreger als Community-acquired methicillin-resistant Staphylococcus aureus (cMRSA oder caMRSA bzw. CA-MRSA) bezeichnet. Darunter gibt es Stämme wie den Pulsed-Field Gelelektrophorese (PFGE)-Typ USA300 (entspricht dem Multi Locus Sequence Typing (MLST)-Typ ST 8) mit besonders aggressivem Verhalten, die das sogenannte Panton-Valentine-Leukocidin aufweisen (PVL-MRSA).
In manchen Regionen der USA wurde CA-MRSA in der Mehrzahl schwerer Haut- und Weichteilinfektionen nachgewiesen. Im Gegensatz zu nosokomialen MRSA-Stämmen spricht CA-MRSA oft auf die Therapie mit einigen nicht-β-Lactam-Antibiotika an.[17]
Nach einer französischen Studie schleppen viele Patienten, die sich im Krankenhaus infiziert haben, diese Bakterien nach ihrer Entlassung in ihre Wohnungen ein.[18][19]
In den USA wurden an fünf von zehn untersuchten öffentlichen Meeresstränden in den Bundesstaaten Kalifornien und Washington MRSA gefunden.[20]
Auch in Klärschlämmen verschiedener Regionen Englands wurden resistente Stämme von Staphylococcus aureus nachgewiesen.[10]
MRSA sind darüber hinaus nicht auf den Menschen beschränkt. In einer Studie wurden 2007 in kanadischen Schweinefarmen MRSA gefunden. Menschen waren in der Hälfte dieser 20 Farmen kolonialisiert, Schweine in einem Viertel. Die genetische Information der Bakterien war jeweils identisch, was eindeutig auf eine Übertragung zwischen Mensch und Tier hinweist.[21]
Schon früher ist man auch in den Niederlanden auf MRSA in der Schweinezucht gestoßen. Es hat sich dort gezeigt, dass in Betrieben, in denen Schweine routinemäßig mit Antibiotika behandelt wurden, 60 % der Schweine mit MRSA infiziert waren. In Betrieben, in denen die Schweine nicht routinemäßig Antibiotika erhielten, waren nur 5 % mit MRSA infiziert.[22]
In einer internationalen Studie wurde die Rate kolonialisierter Schweinezucht-Arbeiter mit 12 % bestimmt, wobei Schutzkleidung offensichtlich keinen Nutzen hatte.[23]
Bei einer weiteren niederländischen Studie waren 41 % von 540 Schlachtschweinen MRSA-infiziert. Auch im Rahmen des Viehhandels sowie des Schlachtvorganges können die Bakterien verschleppt und dann in Lebensmitteln von entsprechenden Tieren nachgewiesen werden, so in Puten-, Hähnchen- oder Kalbfleisch sowie in Rohmilch.[24]
Todesfälle durch MRSA
In den USA starben im Jahr 2005 etwa 19.000 Menschen allein an Infektionen mit MRSA.[25]
Für Deutschland gehen die Schätzungen der Todesfälle durch im Krankenhaus erworbene Infektionen weit auseinander, von jährlich etwa 1500 Todesopfern[26] bis zu etwa 40.000.[27] Auch die Deutsche Gesellschaft für Krankenhaushygiene schätzte 2009 etwa 40.000 Todesfälle jährlich durch in deutschen Krankenhäusern zugezogene Infektionen.[28] Das wäre deutlich mehr als die durchschnittliche jährliche Übersterblichkeit durch die saisonale Influenza. Die ungenauen Angaben liegen unter anderem darin begründet, dass MRSA in Deutschland – anders als beispielsweise in Großbritannien – nicht im Totenschein als Diagnose vermerkt wird. Es müsste zudem unterschieden werden, ob die MRSA-Infektion tatsächlich todesursächlich war oder nur eine klinisch unbedeutende Infektion bzw. Kolonisation mit MRSA bestand.
Eine MRSA-Infektion erhöht in Deutschland das Risiko, bei einem Klinikaufenthalt zu sterben, um den Faktor 2,7.[29]
Therapie
Zwar kann versucht werden, Infektionen mit MRSA mit so genannten Reserveantibiotika wie Vancomycin und neuerdings Linezolid, Daptomycin, Tigecyclin oder Quinupristin/Dalfopristin zu behandeln. Letztere sind auch gegen vancomycinresistente Staphylococcus aureus wirksam, Linezolid kann auch oral verabreicht werden. Nachdem es im Zusammenhang mit Linezolid-Anwendung zu erhöhter Sterblichkeit kam (weil nicht gegen gram-negative Erreger wirksam, s. Warnhinweise des BfArM[30]), gelten Tigecyclin, Daptomycin neben Vancomycin als Mittel der Wahl. Doch im klinischen Alltag gestaltet sich die Therapie von Patienten mit MRSA-Infektionen oft schwierig und langwierig. Bei manchen Patienten, die bereits auf dem Weg der Besserung sind, ist es möglich, die Antibiotikabehandlung zu beenden. Dann kann sich auch die normale Mikroorganismengesellschaft von Haut- und Schleimhaut regenerieren und verdrängt die MRSA wieder.
Bakteriophagen wurden bis zur Einführung der Antibiotika gegen Infektionen eingesetzt und könnten eine Behandlungsoption gegen multiresistente Bakterien bieten. Aktuelle Erfahrungen gibt es bislang nur in der ehemaligen Sowjetunion [31] und Polen[32].
Aktuelle japanische Studien haben ergeben, dass ein verwandtes Bakterium, Staphylococcus epidermidis, ein Enzym bildet, das den Biofilm des Staphylococcus aureus zerstören und Bildung neuer Biofilme verhindern soll.[33]
Vorsorge
Es sind vor allem falsche und schlecht durchgeführte Therapien, durch die resistente Erreger gezüchtet werden.[34] Das Auftreten von MRSA-Stämmen im Krankenhaus erfordert gezielte antiepidemische Maßnahmen mit Isolierung des Patienten oder mehrerer mit MRSA besiedelten Patienten in einem Zimmer – sogenannte Kohortenisolierung. Da die Erreger im Krankenhaus meist von Pflegepersonal und Ärzten (iatrogen) verbreitet werden, ist die wichtigste Maßnahme gegen die Ausbreitung multiresistenter Erreger die gründliche Händedesinfektion. Je nach der zu verrichtenden Tätigkeit am Patienten oder der Lokalisation des MRSA beim Patienten werden zusätzlich Einmalhandschuhe, Schutzkittel und Mundschutz getragen. Die strikte Einhaltung der Händehygiene ist der wichtigste Teil der Vorsorge. Isolierungsmaßnahmen können die Übertragungsrate in Krankenhäusern deutlich verringern.[35] Führungskräften kommt dabei eine wichtige Vorbildfunktion zu.[36]
Vom Robert-Koch-Institut (RKI) werden Screening-Untersuchungen in Krankenhäusern bisher nur für bestimmte Gruppen empfohlen:
- bei Patienten mit beispielsweise chronischer Pflegebedürftigkeit, liegenden Kathetern, chronischen Wunden
- beim Krankenhauspersonal bei Ausbruch, d. h. bei gehäuftem Nachweis von MRSA bei mehr als zwei Patienten, die in einem räumlichen und zeitlichen Zusammenhang stehen, und bei nachgewiesener klonaler Identität des MRSA.
Dagegen hält das RKI bisher das Screening aller zur Aufnahme kommenden Patienten und des gesamten Personals noch für zu aufwändig, und das Gesundheitsministerium des Bundes verweist auf die Zuständigkeit der Länder.[37] So hat das Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit Ende 2009 eine Landes-Arbeitsgemeinschaft Multi-Resistente Erreger (LARE) eingerichtet, die auch eine Telefon-Hotline und Website unterhält.[38]
In Deutschland haben nur fünf Prozent der deutschen Kliniken einen Hygienearzt – mit sinkender Tendenz. In den Niederlanden hingegen umfassen die Schutzmaßnahmen das Screening aller zur Aufnahme kommenden Patienten, den Einsatz eines Hygienefacharztes in jeder Klinik und die Abstimmung jeder Antibiotika-Behandlung mit einem Mikrobiologen. Hierunter kam es zu einer massiven Absenkung der MRSA-Prävalenz mit einer Häufigkeit von 20% der im benachbarten Deutschland auftretenden Fälle.[34] Auch ist die Häufigkeit von MRSA des benachbarten Raums Münster gesunken, nachdem dort seit 2006 in über 40 Kliniken im Rahmen des EUREGIO-Projektes MRSA-net ein Verfahren ähnlich dem niederländischen eingeführt wurde.[39][40]
Experten halten ein ähnliches Vorgehen für den Rettungsdienst und Krankentransport für sinnvoll. Da viele Patienten, die in klinischer Behandlung waren, Träger von MRSA sind, ohne es zu wissen oder die entsprechenden Symptome zu zeigen, sollte das Rettungsfachpersonal die Anamnese auch auf solche Krankheiten hin betreiben. Der Transport eines MRSA-positiven Patienten erfordert vom Rettungsfachpersonal das Tragen von Schutzkleidung und Einmalhandschuhen sowie eine Schlussdesinfektion des kompletten Fahrzeugs. Hierbei steht nicht der Schutz des Personals im Vordergrund (Eine Kolonialisation mit MRSA bleibt für Gesunde in der Regel folgenlos), sondern eine Eindämmung der Verbreitung von MRSA, da der Rettungs- bzw. Krankentransportdienst durch die hohe Zahl von Patientenkontakten und den häufigen Aufenthalt in Kliniken einen wirksamen Vektor darstellt.[41] Dies zusätzlich deshalb, weil bisher bei der Entlassung von infizierten Patienten eine Dekolonisierung ausbleibt, da deren Kosten bis heute nicht von den Krankenkassen getragen werden.[36]
Zum 1. Januar 2011 soll im deutschen Bundesland Baden-Württemberg eine neue Hygieneverordnung für Kliniken, Vorsorge- und Rehabilitationseinrichtungen verbindlich in Kraft treten, um die Anzahl der Klinikinfektionen einzudämmen und eine landeseinheitliche Systematik für die Infektionsprävention zu schaffen.[42][43] Dabei soll ein effizientes Hygienemanagement etabliert werden, das heißt u. a. soll die Erstellung von Hygieneplänen sowie die Benennung von Ansprechpersonen und Beauftragten, welche sich um die Einhaltung von Vorschriften kümmern sollen, verbindlich geregelt und vorgeschrieben werden.
Im häuslichen Bereich sollen die üblichen konservativen Hygienemaßnahmen eingehalten werden, also ohne die Verwendung von Desinfektionsmitteln (siehe oben: Resistenzbildungen eben durch Desinfektionsmittel), Fleisch nicht roh verzehrt und insbesondere Kleinkindern keine rohe Milch zu trinken gegeben werden.[24]
Zusammenfassend können Neuentstehung und Ausbreitung von MRSA durch drei Vorgehensweisen bekämpft werden:
- durch den rationellen und erregerorientierten Einsatz von Antibiotika sowie durch deren Nichtanwendung, falls es nicht erforderlich ist (beispielsweise bei leichteren Virusinfektionen der Atemwege ohne größere Gefahr der Zweitinfektion mit Bakterien)
- durch konsequentes Umsetzen von (vorbeugenden) Hygienemaßnahmen im Krankenhaus
- durch Screening aller Patienten sofort bei der Aufnahme im Krankenhaus mit Isolierung und Sanierung betroffener Patienten, wie es weiter oben unter "Niederlande" beschrieben wurde. Ein Kostenvergleich des niederländischen Systems mit dem in Deutschland bislang vorherrschenden sollte inzwischen möglich sein. Trotzdem wären Kosten allein nicht relevant, da die Vermeidung von Todesfällen und schweren Komplikationen selbstverständlich Vorrang hat.
Psychosoziale Effekte einer MRSA-Infektion wurden in Deutschland bisher (März 2010) völlig unzulänglich erforscht.[44]
Meldepflichten, Versorgung und Kennzeichnung von Verstorbenen mit MRSA [Bearbeiten]
Seit dem 1. Juli 2009 müssen MRSA-Infektionen in Blut oder Hirnwasser den zuständigen Gesundheitsbehörden gemeldet werden.[45] Wenn aber Patienten, die anderweitig Träger vom MRSA waren, in der Klinik oder einer anderen Einrichtung sterben, so ist diese Besiedelung nach dem Infektionsschutzgesetz nicht meldepflichtig. Der die Leichenschau durchführende Arzt wird deshalb auf der Todesbescheinigung in solchen Fällen unter Infektionsgefahr NEIN ankreuzen, und es gelten beim Umgang mit diesen Leichen die üblicherweise erforderlichen (einfacheren) Hygienemaßnahmen als ausreichend.
Phytotherapie
Extrakte verschiedener Pflanzenarten zeigen im Labor teilweise hohe Aktivität gegen MRSA mit mehreren Resistenzen, die in manchen Fällen synergistisch mit Penicillinen ist (hier: verstärkend auf das eingenommene Penicillin reagiert) : hohe Aktivität zeigte Indisches Basilikum (Ocimum tenuiflorum), weiterhin Darjeeling-Tee (Camellia sinensis), der Flammenbaum (Delonix regia), Holarrhena antidysenterica, der Hennastrauch (Lawsonia inermis), Granatapfel (Punica granatum), Terminalia chebula und Terminalia belerica (zwei Flügelsamengewächse).
Andererseits waren Knoblauch (Allium sativum) und Orange (Citrus sinensis) wenig aktiv. In allen genannten Pflanzenextrakten konnten Phenole und Flavonoide als Träger der Aktivität festgestellt werden.[46] In einer anderen Laborstudie waren neben dem genannten indischen Basilikum auch Sesamöl und Sojabohnenöl moderat wirksam.[47][48]
Dem Öl der Himalaya-Sorte von Oregano (Oreganum vulgare) wurden 2008 höchst wirksame Eigenschaften gegen MRSA nachgewiesen. In Studien zeigte es eine höhere Effektivität als 18 derzeit im Einsatz befindliche Medikamente. Zuvor waren antimikrobielle Wirkungen des Öls der mediterranen Sorte bekannt. In beiden Fällen ist Carvacrol der Haupt-Wirkstoff.[49][50]
In der klinischen Routine werden diese Stoffe angesichts noch nicht ausreichender Wirksamkeitsnachweise (Stand 2008) nicht eingesetzt.
Suche nach neuen Antibiotika
Eine gemeinsame Forschergruppe der Universitäten Bonn und Düsseldorf, gefördert von der Deutschen Forschungsgemeinschaft, zeigte in verschiedenen Studien, dass Acyldepsipeptide (ADEPs) gegen grampositive Bakterien wirken, darunter auch gegen den Staphylococcus aureus. Während herkömmliche Antibiotika bestimmte Reaktionen in Bakterienzellen hemmen, greifen die Acyldepsipeptide (ADEPs) an einer anderen Schlüsselstelle in den Stoffwechsel der Bakterien ein. Sie führen zu einer Fehlsteuerung eines wichtigen Enzyms. Die Zellteilung und dadurch die Vermehrung der Erreger wird verhindert.[51]
Literatur
- Kipp, Frank; Friedrich, Alexander W.; Becker, Karsten; von Eiff, Christof: Bedrohliche Zunahme Methicillin-resistenter Staphylococcus-aureus-Stämme: Strategien zur Kontrolle und Prävention in Deutschland Dtsch Arztebl 2004; 101(28-29): A-2045 online
- Mitteilung der Kommission für Krankenhaushygiene und Infektionsprävention am RKI: Empfehlung zur Prävention und Kontrolle von Methicillin-resistenten Staphylococcus aureus-Stämmen (MRSA) in Krankenhäusern und anderen medizinischen Einrichtungen Bundesgesundheitsblatt 1999, 42 (12) S. 954-958 Seite des RKI mit Informationen zu MRSA, als PDF von dort downloadbar
- Medizinische Wirksamkeit und Kosten-Effektivität von Präventions- und Kontrollmaßnahmen gegen MRSA-Infektionen im Krankenhaus 47 kB,
- Kurzfassung des DIMDI-HTA-Berichts vom 17. März 2010, abgerufen am 10. April 2010
- Köck, R. et al.: Methicillin-resistenter Staphylococcus aureus in Deutschland: Epidemiologie. In: Dtsch Arztebl Int. Nr. 108(45), 2011, S. 761-7 (Übersichtsarbeit).
Einzelnachweise
- ↑ Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/Wien 1965.
- ↑ Christof R. Hauck, Franziska Agerer, Petra Muenzner, Tim Schmitter: Cellular adhesion molecules as targets for bacterial infection. In: European Journal of Cell Biology. 3-4, Nr. 85, 2006, S. 235-242, doi:10.1016/j.ejcb.2005.08.002 .
- ↑ M. Labandeira-Rey, F. Couzon, S. Boisset, E. L. Brown, M. Bes, Y. Benito, E. M. Barbu, V. Vazquez, M. Hook, J. Etienne: Staphylococcus aureus Panton-Valentine Leukocidin Causes Necrotizing Pneumonia. In: Science. 315, Nr. 5815, 2007, S. 1130–1133, doi:10.1126/science.1137165 .
- ↑ http://www.xxx
- ↑ Jevons M: Celbenin – resistant Staphylococci. In: Br Med J. 5219, Nr. 1, Januar 1961, S. 124–5. Volltext bei PMC: 1952888 .
- ↑ SUTHERLAND R, ROLINSON GN: CHARACTERISTICS OF METHICILLIN-RESISTANT STAPHYLOCOCCI. In: J. Bacteriol.. 87, April 1964, S. 887–99. PMID 14137628 . Volltext bei PMC: 277108 .
- ↑ wdr.de Zusammenfassung des Films Tatort Krankenhaus – Warum Händewaschen Menschleben rettet und Links zu weiteren Sachinformationen
- ↑ http://www.xxx
- ↑ http://xxx
- ↑ a b c Wolfgang W. Merkel: Seifen machen gefährliche Bakterien resistent auf Die Welt vom 2. April 2009. Abgerufen am 2. November 2009
- ↑ Warum Staphylococcus aureus so hartnäckig ist , BMC Genomics
- ↑ http://www.xxx
- ↑ Matthias Günther: Gefährliche Keime: Immer mehr Infektionen in Schleswig-Holsteins Kliniken. abgerufen am 7. Juni 2010: „Nach Schätzungen sind in deutschen Krankenhäusern auftretende Keime zu etwa einem Viertel antibiotikaresistent, in den Niederlanden aber nur zu höchstens drei Prozent.“ Deutschlandfunk, Sprechstunde vom 27. April 2010
- ↑ Woltering R et al: MRSA-Prävalenz in medizinischen und pflegerischen Einrichtungen eines Landkreises / Prevalence of methicillin-resistant Staphylococcus aureus (MRSA) in patients in long-term care in hospitals, rehabilitation centers and nursing homes of a rural district in Germany. In: Dtsch med Wochenschr 2008; 133(19): 999-1003. Abgerufen am 7. Juni 2010 (deutsch/englisch). PMID 18446675
- ↑ http://www.xxx
- ↑ Udo EE, Pearman JW, Grubb WB: Genetic analysis of community isolates of methicillin-resistant Staphylococcus aureus in Western Australia.. In: J Hosp Infect 1993;25:97-108. PMID 7903093
- ↑ Bassetti M, Nicco E, Mikulska M: Why is community-asscociated MRSA spreading across the world and how will it change clinical practice? Int J Antimicrob Agents. 2009 Jul;34 Suppl 1:S15-9. PMID 19560669
- ↑ http://www.xxx
- ↑ http://www.xxx
- ↑ http://www.xxx
- ↑ T. Khanna et al.: Methicillin resistant Staphylococcus aureus colonization in pigs and pig farmers. Vet. Microbiol. In Press, Accepted Manuscript, Available online 16 October 2007 doi:10.1016/j.vetmic.2007.10.006
- ↑ Michael Pollan The Way We Live Now – Our Decrepit Food Factories. The New York Times, Available online 23 Februar 2009 2007 online
- ↑ M. W. Wulf et al.: Prevalence of methicillin-resistant Staphylococcus aureus among veterinarians: an international study. Clin Microbiol Infect. 6 Nov 2007 doi:10.1111/j.1469-0691.2007.01873.x
- ↑ a b Gudrun Heyn: Problemkeime in der Nahrung in der Pharmazeutischen Zeitung, Ausgabe 19/2009.
- ↑ Online-PDF Klevens et al.: Invasive Methicillin-Resistant Staphylococcus aureus Infections in the United States
- ↑ http://www.xxx
- ↑ http://www.xxx Westdeutscher Rundfunk, Fernsehen, "die story", Sendung vom 26. Oktober 2009, Killerbrut, die verschwiegene Katastrophe
- ↑ http://www.xxx
- ↑ http://www.xxx
- ↑ Linezolid (Zyvoxid®): Erhöhte Mortalität bei schweren Haut- und Weichteilinfektionen, die nicht ausschließlich durch grampositive Erreger verursacht werden – Anwendungsbeschränkungen beschlossen. In: Pharmakovigilanz/Risikoinformationen. Bundesinstitut für Arzneimittel und Medizinprodukte, 16. März 2007, abgerufen am 5. Mai 2010.
- ↑ Kropinski AM: Phage therapy – everything old is new again. Can J Infect Dis Med Microbiol 2006 (17):297–306.
- ↑ Miedzybrodzki R, et al.: Phage therapy of staphylococcal infections (including MRSA) may be less expensive than antibiotic treatment. Postepy Hig Med Dosw (Online) 2007 (61):461-5. PMID: 17679835
- ↑ Tadayuki Iwase (Jikei University School of Medicine, Tokyo) et al.: Nature, Bd. 465, Nr. 7296, S. 346
- ↑ a b http://www.xxx www.xxx, 6. September 2010, Ratgeber Gesundheit und Ernährung, Michael Brendler: Problemkeime im Krankenhaus
- ↑ http://www.xxx
- ↑ a b Katja Schmidt: Chefs müssen gute Hygiene vorleben , in Ärztezeitung, vom 26. Juni 2009. Abgerufen am 10. November 2009
- ↑ http://www.xxx Westdeutscher Rundfunk, Fernsehen, „die story“, Sendung vom 26. Oktober 2009, Killerbrut, die verschwiegene Katastrophe
- ↑ http://www.xxx
- ↑ http://www.xxx
- ↑ MRSA-Net
- ↑ Infektionen mit Methicillin-resistentem Staphylococcus aureus: Bedeutung des Pathogenitätsfaktors Panton-Valentine Leukozidin, Deutsche Medizinische Wochenschrift, 2005, März, 18;130(11):582-5; quiz 589-92
- ↑ Badische Zeitung, Freiburg, gedruckte Ausgabe vom 22. April 2010, Seite 8
- ↑ www.xxx, 4. August 2010
- ↑ MRSA im Krankenhaus: Prävention und Kontrolle erfolgreich- Weitere Forschung notwendig, DIMDI- Pressemitteilung vom 17. März 2010 , abgerufen am 10. April 2010
- ↑ Patientensicherheit stärken – neue Meldepflicht bei MRSA, EUREGIO MRSA-net Twente/Münsterland, Neuigkeiten vom 28. Mai 2009 , abgerufen am 10.April 2010
- ↑ F. Aqil et al.: Effect of certain bioactive plant extracts on clinical isolates of beta-lactamase producing methicillin resistant Staphylococcus aureus. J Basic Microbiol. 45/2/2005. S. 106-14. PMID 15812867
- ↑ S. Singh et al.: Antibacterial activity of Ocimum sanctum L. fixed oil. Indian J Exp Biol. 43/9/2005. S. 835-7. PMID 16187537
- ↑ Klaus Hönninger: in: Ethnoline Peru: Impacto de la combinacion de Croton Lechleri, Piper Angostifolium y Plantago Major en la curacion de Estafiloco Aureus en las vias respiratorias superiores Lima 2006
- ↑ Himalayan Oregano Effective Against MRSA . Medical News Today (24 November 2008). Abgerufen am 26. November 2008.
- ↑ Scientists win SEED award for Himalayan oregano project . University of the West of England (28. Oktober 2008). Abgerufen am 26. November 2008.
- ↑ Uni Bonn 5. Oktober 2011: NEUES ANTIBIOTIKUM TREIBT BAKTERIEN IN DEN SELBSTMORD
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Staphylococcus epidermidis
Staphylococcus epidermidis (syn. Staphylococcus albus, Micrococcus epidermidis) ist ein grampositives, plasmakoagulase-negatives, saprophages Bakterium, das die menschliche Haut und Schleimhaut besiedelt. Des Weiteren ist er auf Lebensmitteln zu finden und siedelt auch auf polymeren Oberflächen (siehe Biofilm).
Gefahren
Für Menschen mit normaler immunologischer Abwehr bedeutet das Bakterium wenig Gefahr. Aber im Krankenhaus, bei abwehrgeschwächten Menschen, kann es, bei Unsauberkeit, Ursache für schwere Erkrankungen, sogenannte nosokomiale Infektionen, sein. Häufig löst es Endokarditis nach Operationen am offenen Herzen, Infektionen nach dem Einsetzen von Prothesen, Plastizitis bei länger liegenden Kathetern oder Drainagen aus. Bei diesen Infektionen (durch Koagulase-negative Staphylokokken) beträgt der Anteil von S. epidermidis 70 bis 80 Prozent[1] und ist damit der häufigste Auslöser bei fremdkörperinduzierten Infektionen.
Therapie
S. epidermidis besitzt ein großes Spektrum bei Antibiotikaresistenzen. Dies gilt vor allem gegen Penicillin und Methicillin. Der Anteil resistenter Stämme liegt aktuell bei 70%[1]. Daher ist ein Antibiogramm zur Therapie besonders wichtig.
Quellen
- ↑ a b http://www.xxx
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
β-Lactam-Antibiotika - Betalactam-Antiobiotika
(Weitergeleitet von Betalactam-Antiobiotika)
Die β-Lactam-Antibiotika sind eine Gruppe von Antibiotika/antibakteriellen Antiinfektiva, die alle in ihrer Strukturformel einen viergliedrigen Lactam-Ring aufweisen. Sie gehen auf das Penicillin zurück, das der englische Bakteriologe Alexander Fleming 1928 aus Kulturen des Schimmelpilzes Penicillium notatum extrahierte, welches zugleich den wichtigsten und bekanntesten Vertreter dieser Gruppe darstellt. Sie wirken alle bakterizid, indem sie die Peptidoglycansynthese bei der Zellteilung hemmen. Unterschiede in der Wirksamkeit begründen sich vor allem durch differente Affinität und Penetrationsfähigkeit. β-Lactam-Antibiotika werden heutzutage überwiegend halbsynthetisch erzeugt.
Um 1940 entwickelten Howard Walter Florey und Ernst Boris Chain Medikamente auf Basis des Penicillins, welche ein Jahr später zum ersten Mal therapeutisch eingesetzt wurden. Dafür erhielt Fleming 1945, gemeinsam mit den zwei anderen Wissenschaftlern, den Nobelpreis für Medizin. Damals wurden Penicillinpräparate häufig falsch eingesetzt, besonders auch gegen Krankheitserreger, die von Natur aus gegen β-Lactam-Antibiotika resistent sind. Inzwischen haben viele ursprünglich empfindliche Krankheitserreger eine Antibiotikum-Resistenz gegen β-Lactampräparate entwickelt, so dass ständig der Zwang zur Entwicklung neuer Medikamente besteht.
Wirksamkeit
Alle β-Lactam-Antibiotika sind unwirksam gegen Mykoplasmen, Chlamydien und Legionellen. Daneben existieren auch bei manchen anderen Bakterien erworbene Resistenzen, die auf einer β-Lactamase beruhen.
Nebenwirkungen
β-Lactam-Antibiotika sind in der Regel für den Menschen gut verträglich, was auf den Wirkungsmechanismus zurückzuführen ist. Sie greifen in die Zellwandsynthese von sich teilenden Bakterien ein - dieser Stoffwechselvorgang kommt beim Menschen nicht vor. Jedoch existieren inzwischen viele Allergien gegen Penicillin und verwandte Substanzen, die von leichten Hautreaktionen bis zum anaphylaktischen Schock in allen Schweregraden reichen können. Auch muss mit Kreuzallergien zwischen den einzelnen β-Lactam-Antibiotika gerechnet werden.
Einteilung in Gruppen
Man unterscheidet heute vier Gruppen von β-Lactam-Antibiotika:
- Penicilline
- β-Lactamase-sensitive (-instabile) Penicilline
- Benzylpenicillin (Penicillin G)
- Phenoxymethylpenicillin (Penicillin V)
- Propicillin
- Azidocillin
- β-Lactamase-resistente (-stabile) Penicilline
- Flucloxacillin
- Dicloxacillin
- Cloxacillin
- Oxacillin
- Methicillin
- Breitbandpenicilline oder Breitspektrumpenicilline
- Aminopenicilline
- Amoxicillin
- Ampicillin
- Bacampicillin
- Mezlocillin
- Piperacillin
- Pivmecillinam
- Cephalosporine
- Cephalosporine zur parenteralen Anwendung
- Cephalosporine ohne erhöhte β-Lactamase-Stabilität
- Cephalosporine mit erhöhter β-Lactamase-Stabilität
- Cefuroxim
- Cefamandol
- Cefoxitin
- Cefotiam
- Breitspektrumcephalosporine
- Cefotaxim
- Cefovecin
- Ceftazidim
- Cefepim
- Cefodizim
- Ceftriaxon
- Oralcephalosporine
- Oralcephalosporine ohne erhöhte β-Lactamase-Stabilität
- Cefaclor
- Cefadroxil
- Cefalexin
- Loracarbef
- Oralcephalosporine mit erhöhter β-Lactamase-Stabilität
- Cefixim
- Cefuroximaxetil
- Cefetametpivoxil
- Ceftibuten
- Cefpodoximproxetil
- β-Lactamase-Inhibitoren
- Clavulansäure in Kombination mit Amoxicillin
- Sulbactam
- Tazobactam in Kombination mit Piperacillin
- Sonstige β-Lactam-Antibiotika
- Carbapeneme
- Imipenem in Kombination mit Cilastatin
- Meropenem
- Ertapenem
- Monobactame
Resistenzen und Mechanismen
Während der Anwendung von β-Lactam-Präparaten entwickeln sich zwar nur selten und langsam Resistenzen gegen dieselben, jedoch stellen sie inzwischen ein ernsthaftes Problem dar. Hierbei sind drei Resistenzmechanismen zu unterscheiden:
- unempfindliche Penicillin-Bindeproteine
- Membranveränderungen
- Bildung von β-Lactamasen
Hierbei bilden die Bakterien Enzyme, die den β-Lactam-Ring der Antibiotika öffnen und diese damit inaktivieren. Die genetische Information hierfür wird chromosomal oder plasmidal vererbt. Je nach ihrer Wirkung werden die β-Lactamasen als Penicillinasen oder Cephalosporinasen bezeichnet.
Um β-Lactamase-stabile Penicilline zu erhalten werden voluminöse Gruppen in das Penicillinmolekül eingeführt, die die β-Lactamase sterisch behindern. Ebenfalls möglich ist die Anwendung von β-Lactamase-Hemmstoffen, wie Clavulansäure, Sulbactam oder Tazobactam.
β-Lactam-Antibiotika blockieren nicht nur die Teilung von Bakterien, inklusive der Cyanobakterien, sondern auch die Teilung der Cyanellen, der photosynthetisch aktiven Organellen der Glaucocystaceaen, sowie der Chloroplasten von Blasenmützenmoosen[1] , Lebermoosen (Marchantia polymorpha[2]) und Moosfarnen (Selaginella nipponica[3]). Auf die Teilung der Plastiden der höher entwickelten Gefäßpflanzen wie beispielsweise bei Tomaten haben sie jedoch keinen Effekt. Dies ist ein Hinweis darauf, dass bei höheren Pflanzen durch erfolgte, evolutionäre Veränderungen der Plastidteilung β-Lactam-Antibiotika auf Chloroplasten keine Wirkung mehr zeigen.[1]
Literatur
- Claus Simon, Wolfgang Stille: Antibiotika-Therapie in Klinik und Praxis. 10. Auflage. Schattauer, Stuttgart 2001, ISBN 3-7945-1970-1
- Peter Imming: Wie macht der Pilz das Penicillin? Aktuelle Forschung, Trends bei β-Lactam-Antibiotika. Biosynthese der Penicilline und Cephalosporine. Pharmazie in unserer Zeit 18(1), S. 20 – 24 (1989), ISSN 0048-3664
Einzelnachweise
- ↑ a b Kasten, Britta und Reski, Ralf (1997): β-lactam antibiotics inhibit chloroplast division in a moss (Physcomitrella patens but not in tomato (Lycopersicon esculentum). In: J. Plant Physiol. 150, 137–140; PDF (freier Volltextzugriff, engl.)
- ↑ Tounou, E. et al. (2002): Ampicillin Inhibits Chloroplast Division in Cultured Cells of the Liverwort Marchantia polymorpha. In: Cytologia 67; 429–434; doi:10.1508/cytologia.67.429
- ↑ Izumi, Y. et al. (2003): Inhibition of plastid division by ampicillin in the pteridophyte Selaginella nipponica Fr. et Sav. In: Plant Cell Physiol. 44(2):183–189; PMID 12610221 ; PDF
- (freier Volltextzugriff, engl.)
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Mykobakterien
Die Mykobakterien (Mycobacterium) bilden eine Gattung bestehend aus ca. 100 Arten. Sie sind die einzigen Vertreter der Familie Mycobacteriaceae. Zu ihnen gehören Krankheitserreger des Menschen wie Mycobacterium tuberculosis (Tuberkulose) und Mycobacterium leprae (Lepra), Krankheitserreger von Tieren wie der Erreger der Rindertuberkulose (Mycobacterium bovis), aber auch freilebende Arten.
Mykobakterien sind mit der Gram-Färbung schlecht anzufärben, ihr Zellwandaufbau entspricht aber weitgehend dem Wandaufbau grampositiver Bakterien, d. h. die Zellwand besitzt keine äußere Membran und besteht aus einem mehrschichtigen Peptidoglykan (Murein). Die Einordnung zu den grampositiven Bakterien wurde auch durch RNA-Analysen bestätigt. Aufgrund des hohen GC-Gehaltes in ihrer DNA werden sie zu den Actinobacteria, einer Abteilung von grampositiven Bakterien, gestellt.
Merkmale
Allgemeine Merkmale
Mykobakterien sind immer auf Sauerstoff angewiesen (obligat aerob) und benötigen organische Stoffe zum Energiegewinn (chemoorganotroph). Sie sind meist stäbchenförmig und bilden nur selten in älteren Kulturen Verzweigungen, die dann oft wieder in Kokken (Kugelbakterien) oder Stäbchen zerfallen. Im Gegensatz hierzu bildet die Mehrzahl der Aktinomyzeten verzweigte Mycelien, die den von Pilzen gebildeten Mycelien gleichen, man spricht von den filamentösen Aktinomyzeten. Auf dieser Eigenschaft beruht auch der Name, Aktinomyzeten bedeutet soviel wie „Strahlenpilze“ (griechisch „aktis“ für Strahl und „mykes“ für Pilz).
Zellhülle
Eines der Hauptmerkmale von Mykobakterien ist, dass ein Großteil der Zellwandbestandteile als Antigenkomponenten wirkt. Sie rufen in Wirtsorganismen eine Immunreaktion hervor und führen zu einer Allergie vom Spättyp (Typ IV). Die bekannteste Reaktion ist die Tuberkulinreaktion.
Charakteristisch sind der hohe Lipidgehalt der Zellwand, die Mykolsäuren, die Phthiocerol-Außenhülle und speziell bei Mycobacterium tuberculosis und Mycobacterium bovis der Cord-Faktor, die Verbindungen der Mykolsäuren mit dem Disaccharid Trehalose. Durch den Cord-Faktor kommt es zu dem schnur- oder zopfartigen Wachstum in älteren Kulturen.
Die sehr hohe Säurefestigkeit (engl.: acid-fast) kommt durch die langkettigen Mykolsäuren zustande. An jeder 10ten N-Acetylmuraminsäure (welches zum Rückgrat des Peptidoglycan gehört) ist ein Arabinogalaktankomplex gebunden. Dieser besteht aus einem linearen Galaktose-Strang und ist verzweigt mit Arabinose-Ketten. An diese Komplexe sind wiederum Mykolsäuren gebunden. Nicht kovalent an die nach außen zeigenden Mycolsäuren geheftet ist schließlich die DIM/DIP-Schicht.[1]
Die Zellwand der Mykobakterien hat demnach so etwas wie einen weiteren äußeren Bilayer.
Aufgrund dieses Zellwandaufbaus besitzen Mykobakterien eine sehr hohe Widerstandsfähigkeit. Dies bewirkt, dass die obligat parasitären Mykobakterien auch in der freien Natur unter günstigen Bedingungen mehrere Monate infektionsfähig bleiben[2] und mit wenigen Ausnahmen (z. B. Streptomycin oder Kanamycin) gegen die meisten Antibiotika resistent sind. Auch gegen die meisten Laugen und Säuren sind sie widerstandsfähiger als andere Bakterien. Die Säurefestigkeit ist durch die Ziehl-Neelsen-Färbung nachweisbar. Die Bakterienzellen lassen sich nach Einfärbung mit Anilinfarbstoffen (z. B. Karbolfuchsin) mit Säure nicht mehr entfärben. Ein Effekt, den Paul Ehrlich in Zusammenarbeit mit Robert Koch im Jahre 1882 erstmals bemerkte. Die Säurefestigkeit tritt nur bei wenigen Bakterienarten, wie Nocardia, Rhodococcus und Corynebacterium, auf.
Physiologie
Mykobakterien nutzen u.a. Triacylglycerine (Neutralfette, TAGs) als Reservestoffe[3]. Diese Neutralfette werden in Granula, so genannten „fat bodies“, innerhalb des Zellkörpers angehäuft[4]. Triacylglycerine als Speicherlipide sind bei Eukaryoten, wie Hefen oder Pilze, weit verbreitet, unter den Bakterien sind sie allerdings seltener anzutreffen. Vor allem bei den Actinomycetales, wie Mycobacterium, Streptomyces, Rhodococcus und Nocardia, ist die intracelluläre Akkumulation von TAGs nachgewiesen[5]. Auch bestimmte Wachse, so genannte Wachsester, werden von einigen Vertretern der Actinomycetalen als Speicherstoffe genutzt[5]. Bei den Mykobakterien wurden sie z.B. bei Mycobacterium tuberculosis gefunden. Wachsester als Reservestoffe treten im Bakterienreich eher selten auf, außer bei den Actinomycetales wurden sie z. B. noch bei Moraxella und Alcanivorax, beides den Proteobakterien zugehörig, nachgewiesen[5]. Wachsester als Reservestoffe sind bei den Eukaryoten kaum anzutreffen, z.B. in Samen der Jojoba-Pflanze. Auch Glykogen und Trehalose werden als mögliche Speicherstoffe der Mykobakterien angesehen[4].
Bei verschiedenen Mycobakterien (darunter auch Mycobacterium tuberculosis) ist der Citratzyklus verändert: die E1-Untereinheit der Ketoglutarat-Dehydrogenase ist durch eine Ketoglutarat-Decarboxylase ersetzt, die unabhängig von Coenzym A zunächst Succinat-Semialdehyd produziert, welches von einer NADP+-abhängigen Succinat-Semialdehyd-Dehydrogenase zu Succinat dehydriert wird.[6]
Vorkommen
Nur wenige der rund 100 Arten sind als Parasiten auf den Wirt als Lebensort angewiesen. Die Mehrzahl der Arten leben im Gegensatz zu dem meist auf die Wirte angewiesenen Mycobacterium tuberculosis-Komplex frei in der Umwelt und sind nicht krankheitserregend (apathogen). Diese Arten werden den nichttuberkulösen, apathogenen Mykobakterien zugerechnet. Man nimmt an, dass der größte Teil der Arten saprophytisch ist, d.h von der Zersetzung toter organischer Stoffe lebt. Sie wurden in Böden und Grundwasser, Staub sowie Süß- und Meerwasser nachgewiesen.[7].
Freilebende Mykobakterien
Beispiele für im Boden vorkommende Mykobakterien sind der Mycobacterium terrae-Komplex (M. terrae, M. triviale und M. nonchromogenicum) und M. fortuitum[7]. Letzteres wurde auch aus Meerwasser isoliert, weitere im Meer gefundene Arten sind Mycobacterium chelonae, M. marinum und M. gordonae. Einige Arten kommen in durch menschlichen Einfluss entstandenen künstlichen Umgebungen wie Abwasser, Klärschlamm oder Trinkwasser vor[7]. Im Trinkwasser wurden häufig Arten wie Mycobacterium gordonae, M. chelonae subsp. chelonae und M. flavescens nachgewiesen. Die im Englischen auch unter den Namen „tap water bacillus“ bekannte Art M. gordonae ist im Trinkwasser das wohl am häufigste Mykobakterium. Einige Arten, wie M. kansasii und M. avium, sind sogar in der Lage, sich in aufbereitetem (destilliertem) Trinkwasser zu vermehren und lassen sich schlecht aus infizierten Leitungswassersystemen wieder entfernen, wodurch sie auch in Krankenhäusern eine erhebliche Gefahr darstellen[7]. Im Abwasser fand man ähnliche Artenzusammensetzungen wie in Böden und Süßwasser. Wie oben schon erwähnt, können die nur in den Wirtszellen Wachstum zeigenden, obligat pathogenen Arten des Mycobacterium tuberculosis-Komplexes außerhalb des Wirtes eine Zeitlang überleben. Im Kot von Rindern soll Mycobacterium bovis bis zu 13 Tage wachstumsfähig sein[2].
Mycobacterium tuberculosis-Komplex
Die meisten Vertreter des obligat pathogenen Mycobacterium tuberculosis-Komplexes leben als obligat intrazelluläre Parasiten in Makrophagen. Virulenzfaktoren sind nicht bekannt, allerdings schützt ihr besonderer Wandaufbau, der wachsartige Substanzen und Mykolsäuren enthält, vor äußeren Einflüssen. Die Lipide der Zellwand sind auch Ursache der charakteristischen Säurefestigkeit. Der Wandaufbau verhindert einen schnellen Stoffaustausch mit der Umgebung und verursacht dadurch ein nur langsames Wachstum und langsame Vermehrung. Dieses im Vergleich zu anderen Bakterien äußerst langsame Wachstum ist charakteristisch für alle Mykobakterien.
Weiters ist für die Mitglieder des Mtb-Komplexes zwar kein Lebenszyklus als Bodenbakterium nachgewiesen, die Fähigkeit allerdings, in Amöben beziehungsweise ihnen anhängenden Zysten überleben zu können, haben sie nicht verloren. Vielmehr ist es diese Eigenschaft der Mykobakterien allgemein, die es den Mtb-complex-Mitgliedern erleichterte, in den (amöbenähnlichen) Fresszellen ihrer Wirte schlafend lange Zeit ohne Zellteilung zu überdauern (latente Infektion).[8]
Wachstumsgeschwindigkeit
In Bezug auf die Wachstumsgeschwindigkeit werden die Mykobakterien in zwei Gruppen unterteilt: Die langsamwachsenden („slow growers“) mit einer Generationszeit von 6–24 Stunden in Laborkulturen und die schnellwachsenden („rapid growers“) mit einer Generationszeit von 1–4 Stunden. Zum Vergleich: Die Generationszeit von Escherichia coli beträgt in Laborkulturen unter günstigen Bedingungen 20 Minuten. Schnell wachsende Mykobakterien bilden innerhalb einer Woche makroskopisch sichtbare Kolonien, langsam wachsende benötigen hierfür bis zu 8 Wochen. Unter den langsam wachsenden Mykobakterien sind die meisten (obligaten oder fakultativen) Krankheitserreger zu finden, viele der „rapid growers“ sind apathogen. Die Unterteilung in langsam und schnell wachsende Mykobakterien ist auch phylogenetisch relevant, sie spiegelt evolutionäre Verwandtschaftsverhältnisse wider[4].
Systematik und Unterteilung
Die Mykobakterien zählen zu der Ordnung Actinomycetales. Ihrer Gestalt nach sind Mykobakterien zwischen den Corynebakterien und den Proactinomyceten (Aktinomyzeten die kein dauerhaftes Mycel bilden wie z. B. Nocardia) einzuordnen, enge Verwandtschaftsverhältnisse bestehen auch zu Rhodococcus und Caseobacter (jetzt zu Corynebacterium gestellt)[4].
Die Gattung wird taxonomisch in drei Gruppen unterteilt:
- Der Mycobacterium tuberculosis-Komplex, die Erreger der Tuberkulose (u. a. Mycobacterium tuberculosis, M. bovis, M. microti und M. africanum)
- Mycobacterium leprae, der Erreger der Lepra
- Alle restlichen Arten werden zu den nichttuberkulösen Mykobakterien gestellt, auch als MOTT (englisch: mycobacteria other than tuberculosis) bezeichnet. Es handelt sich um frei lebende Bakterien, die nur selten krankheitserregend wirken (fakultativ pathogen).
Unterteilung nach Runyon
Nach Runyon erfolgt die Unterteilung der Mykobakterien nach Wachstumsgeschwindigkeit und Pigmentbildung bei Belichtung (sogenannte Photochromogenität). Das Pigmentverhalten ist allerdings phylogenetisch nicht relevant.
- Gruppe I: Photochromogene, langsam wachsende (slow growers) Mykobakterien: Sie bilden nur unter dem Einfluss von Licht gelbe Farbpigmente. Beispielarten: Mycobacterium kansasii, M. marinum, M. asiaticum und M. simiae.
- Gruppe II: Skotochromogene slow growers bilden auch im Dunklen Pigmente. Beispiele: Mycobacterium scrofulaceum, M. szulgai und M. xenopi.
- Gruppe III: Nichtchromogene slow growers bilden niemals Pigmente. Beispielarten: Mycobacterium ulcerans, der Erreger der Buruli-Ulkus und der Mycobacterium avium-Komplex (MAC), bestehend aus Mycobacterium intracellulare und Mycobacterium avium.
- Gruppe IV: Schnellwachsende Mykobakterien, die auf Agarmedien schon innerhalb einer Woche gut sichtbare Kolonien bilden, z. B. Mycobacterium fortuitum.
Der gesamte Mycobacterium tuberculosis-Komplex und Mycobacterium leprae zählen zu der Gruppe III. Apathogene, nicht krankheitserregende Mykobakterien wie M. moriokaense stammen überwiegend aus der Gruppe der schnellwachsenden, nichttuberkulösen Mykobakterien (Gruppe IV).[9]
Arten
Der Mycobacterium tuberculosis-Komplex:
- Mycobacterium africanum Castets et al. 1969
- Mycobacterium canettii
- Mycobacterium bovis Karlson & Lessel 1970, Erreger der Tuberkulose der Rinder
- Mycobacterium microti Reed 1957
- Mycobacterium mungi entdeckt 2010, infiziert Zebramangusten[10]
- Mycobacterium pinnipedii Cousins et al. 2003
- Mycobacterium tuberculosis (Zopf 1883) Lehmann & Neumann 1896, Erreger der Tuberkulose
Einige nichttuberkulöse Mykobakterien (MOTT):
- Mycobacterium ulcerans; Erreger des Buruli-Ulkus
- Mycobacterium xenopi Schwabacher 1959
- Mycobacterium shottsii Rhodes et al. 2003
- Mycobacterium avium-Komplex
- Mycobacterium avium Chester 1901, Erreger der Geflügeltuberkulose
- Mycobacterium avium subsp. paratuberculosis (Bergey et al. 1923) Thorel et al. 1990 (Synonym: Mycobacterium paratuberculosis Bergey et al. 1923), Erreger der chronischen Enteritis beim Rind
- Mycobacterium intracellulare (Cuttino and McCabe 1949) Runyon 1965
- Mycobacterium smegmatis (Trevisan 1889) Lehmann & Neumann 1899
- Mycobacterium kansasii Hauduroy 1955
- Mycobacterium terrae-Komplex: Die Arten dieses Komplexes gehören zu der Gruppe III (langsam wachsend, unpigmentiert) und werden mit Lungenerkrankungen in Verbindung gebracht[9].
- Mycobacterium nonchromogenicum Tsukamura 1965
- Mycobacterium terrae Wayne 1966
- Mycobacterium triviale Kubica 1970
Folgende Arten gelten als apathogen, d. h. bis jetzt wurden sie noch nicht mit Krankheiten des Menschen in Verbindung gebracht. Alle hier aufgelisteten Arten zählen zu den schnellwachsenden Mykobakterien (Gruppe IV)[9]:
- Mycobacterium brumae Luquin et al. 1993
- Mycobacterium chitae Tsukamura 1967
- Mycobacterium confluentis Kirschner et al. 1992
- Mycobacterium fallax Lévy-Frébault et al. 1983
- Mycobacterium moriokaense Tsukamura et al. 1986
Mykobakterien als Krankheitserreger
Einige der normalerweise freilebenden Bakterien können unter Umständen bei Menschen mit geschwächtem Immunsystem Krankheiten verursachen (pathogene nichttuberkulöse Mykobakterien). Einige sind auch gefährliche Krankheitserreger bei Tieren und können in der Tierhaltung bzw. Landwirtschaft große Probleme verursachen.
Viele der um die 100 beschriebenen Arten sind für Menschen apathogen oder nur sehr selten krankheitserregend. Andere sind fakultativ pathogen, sie sind nur unter bestimmten Umständen, zum Beispiel bei geschwächtem Immunsystem, für den Menschen gefährlich. Keine der pathogenen Arten (außer M. tuberculosis) wird von Mensch zu Mensch übertragen. Viele Arten kommen in Böden vor und sind saprophytisch. Zu den nur sehr selten krankheitserregenden Mykobakterien zählen zum Beispiel Mycobacterium triviale, M. gordonae und M. nonchromogenicum.
In der Landwirtschaft beziehungsweise Tierhaltung hat Mycobacterium bovis die größte wirtschaftliche Bedeutung unter den Mykobakterien. Weitere in der Landwirtschaft wichtige Arten sind Mycobacterium avium, M. paratuberculosis (bzw. Mycobacterium avium subsp. paratuberculosis) und auch Mycobacterium tuberculosis. Mycobacterium avium kann die Geflügeltuberkulose bei Puten, Hühner, Tauben und anderen Vögeln auslösen, selten tritt das Bakterium auch bei Schweinen, Pferden und Rindern auf. Auch M. tuberculosis kann bei Hunden, Katzen, Schweinen und Rindern Tuberkulose auslösen. M. paratuberculosis, jetzt als Unterart von Mycobacterium avium geführt, ist der Erreger der Paratuberkulose (Johnsche Krankheit) der Rinder. Für den Menschen ist M. paratuberculosis ungefährlich, während M. avium und M. intracellulare auch pathogen für den Menschen sein können und beispielsweise Lungenkrankheiten verursachen. Mycobacterium avium und Mycobacterium avium ssp. paratuberculosis bilden mit M. intracellulare den „Mycobacterium avium complex“ (MAC).
Zelluläre Infektionswege
Derzeit kennt man zwei Wege wie Mykobakterien Zellen infizieren können: Die lytische und die nicht-lytische Infektion von Zellen.
Bei der lytischen Infektion werden die Bakterien von Phagozyten in die Endosomen aufgenommen, um dort zu überdaueren oder sich zu vermehren. In letzterem Fall gelangen sie ins Zytosol und induzieren die Lyse der Wirtszellen, die hierbei zugrunde geht. Die freigesetzten Mykobakterien können anschließend weitere Zellen infizieren.
Neben dem bekannten Ablauf der lytischen Infektion wurde 2009 bei M. tuberculosis und M. marinum ein weiterer Infektionsweg, die nicht-lytische Infektion oder nicht-lytische Ausschleusung entdeckt.[11] Hierbei werden sogenannte Ejektosomen benutzt, mit Aktinfilamenten angereicherte Regionen der Membran: Durch diese Filamentkomplexe können die Bakterien die Wirtszelle verlassen, ohne dass ein für diese tödliches Leck in der Membran entsteht.
Beim lytischen Infektionsweg werden die Bakterien freigesetzt und können so mit Antibiotika erfolgreich bekämpft werden. Dagegen liegt die medizinische Bedeutung der nicht-lytischen Infektion darin, dass die Bakterien sich im Gewebe von Zelle zu Zelle verbreiten können, ohne dabei von den derzeit verfügbaren Arzneistoffen behelligt zu werden.
Mycobacterium tuberculosis-Komplex
Zu dem aufgrund von rRNA-Analysen erstellten Mycobacterium tuberculosis (Mtu)-Komplex zählen Mycobacterium tuberculosis, M. africanum, M. bovis, M. microti und M. canettii. In den letzten Jahren wurden weiterhin die Arten M. caprae (früher als die Unterart Mycobacterium tuberculosis subsp. caprae geführt) und M. pinnipedii zu dieser Gruppe gestellt.[12] Auch der von M. bovis erzeugte Impfstamm Bacillus Calmette-Guérin (BCG) zählt zu dem Komplex.
Aufgrund der Untersuchung von VNTRs wird angenommen, dass sich die Stämme des Mtu-Komplexes frühestens vor etwa 40000 Jahren aus dem Urahn des Mtu-Komplexes entwickelt haben und mit dem Menschen in die unterschiedlichen Regionen verteilt wurden. Weiterhin ist daraus zu schließen, dass sich die die Tiere infizierenden Stämme aus Stämmen entwickelt haben, die den Mensch infizierten, die Übertragung also vom Mensch ausging.[12][13]
Pathogenität der Arten des Mycobacterium tuberculosis-Komplex
Die Übertragung von Mycobacterium tuberculosis erfolgt durch Tröpfcheninfektion. Mycobacterium tuberculosis kann auch von Menschen auf Tiere übertragen werden. Beim Menschen sind neben den von Mycobacteriumn tuberculosis verursachten Erkrankungen nur die von M. bovis und M. africanum verursachten von nennenswerter Häufigkeit, die anderen Vertreter des Mycobacterium tuberculosis-Komplexes lösen nur sehr selten Tuberkulosen beim Menschen aus.
Der Mensch ist bei dem Komplex nur für Mycobacterium tuberculosis, M. africanum und M. canettii der primäre Hauptwirt.[14] Die anderen Bakterienarten des Komplexes sind primär für Tiere pathogen, können aber auch auf den Menschen übertragen werden und, vor allem wenn eine Immunschwäche vorliegt, humanpathogen wirken und eine Tuberkulose auslösen. Bei diesen Infektionen handelt es sich also um Zoonosen, auch eine sekundäre Übertragung von Menschen zu Tieren ist möglich. Mycobacterium africanum ist ein in Afrika häufig auftretender Tuberkuloseerreger, eventuell ist diese Art jedoch eine Variante von Mycobacterium tuberculosis. Mycobacterium bovis ist ein bei Rindern auftretender Parasit und Erreger der Rindertuberkulose, die aber auf Menschen übertragen werden kann, z. B. durch Aufnahme von nicht pasteurisierter Milch. Mycobacterium microti ist der Verursacher der Tuberkulose bei Wühlmäusen und kann von hier aus auf den Menschen als Tuberkuloseerreger übertragen werden. Mycobacterium pinnepedii ist pathogen für Robben (Robbentuberkulose) und Mycobacterium caprae für Ziegen, eine Übertragung auf den Menschen ist selten[14].
Nichttuberkulöse Mykobakterien
Die nichttuberkulösen Mykobakterien (MOTT) wirken nur selten (meist bei Menschen mit stark geschwächtem Immunsystem) krankheitserregend, sie gelten als fakultativ pathogen. Von einigen wurden bis jetzt noch keine durch sie ausgelöste Erkrankungen nachgewiesen, sie gelten als apathogen.
Den nichttuberkulösen Mykobakterien wurde erst lange Zeit nach der Beschreibung von Mycobacterium tuberculosis und M. leprae in der Medizin Beachtung geschenkt. Vor allem das in den letzten Jahren stark vermehrte Auftreten der Immunschwächekrankheit AIDS führte zu einer Häufung der durch nichttuberkulöse Mykobakterien verursachten Erkrankungen. Bei Infektionen erzeugen diese Arten zum größten Teil nicht-tuberkulöse Lungenentzündungen, Hauterkrankungen (z. B. Buruli-Ulkus durch die in den Tropen und Australien auftretende Art M. ulcerans) und Befall der Lymphknoten.
Weitere Bezeichnungen für diese Gruppe sind MOTT (mycobacteria other than tuberculosis), Nontuberculous mycobacteria (NTM) und „atypische Mykobakterien“. Da sie frei in der Umwelt vorkommen, werden sie auch als „Potentiell pathogene Umwelt (environmental) Mykobakterien“ (PPUM bzw. PPEM) bezeichnet.
Pathogene nichttuberkulöse Mykobakterien
Eine direkte Übertragung von Mensch zu Mensch ist in der Regel nicht möglich. Die Infektion erfolgt meist über infizierte Materialien oder aerogen (Tröpfcheninfektion). Die nichttuberkulösen Mykobakterien sind oft unempfindlich gegen Medikamente, mit denen man die Tuberkulose behandelt (Antituberkulotika) und weisen generell eine hohe Resistenz gegenüber Fremdeinflüssen auf.
Einige pathogene Arten der Gruppe I: Mycobacterium kansasii kann nicht-tuberkulöse Lungenkrankheiten hervorrufen, Humaninfektionen von Mycobacterium marinum können z. B. in Schwimmbädern erfolgen und verursachen Granulome (Schwimmbadgranulome). Zu den pathogenen Arten der Gruppe II zählt Mycobacterium scrofulaceum, der weltweit verbreitete Erreger der Lymphadenitis.
Arten der Gruppe III sind Mycobacterium malmoense (kann Erkrankungen der Lunge hervorrufen), Mycobacterium avium (Auslöser der Geflügeltuberkulose bei Hühnern, Puten, Tauben und anderen Vögeln, selten infiziert es auch Schweine, Rinder oder Pferde. Bei Menschen kann es Lungenerkrankungen und (bei Kindern) Lymphadenitis auslösen. Mycobacterium avium ist das am häufigsten auftretende pathogene Mykobakterium bei AIDS-Patienten und wird zusammen mit Mycobacterium intracellulare, dem aufgrund von genetischen Untersuchungen begründeten Mycobacterium avium-Komplex (MAC) zugeordnet. Bei dem Mycobacterium avium-intracellulare-scrofulaceum-Komplex (MAIS) wird zusätzlich die Art Mycobacterium scrofulaceum hinzugestellt. M. ulcerans ruft das Buruli-Ulkus aus, eine in den Tropen auftretende Hautkrankheit.
Pathogene Arten der Gruppe IV sind Mycobacterium chelonae, das Haut- oder Weichteilerkrankungen, Abszesse und auch Knochen- oder Gelenkerkrankungen hervorruft. Wie Mycobacterium fortuitum, ebenfalls zu der Gruppe IV zählend, besitzt es eine hohe Resistenz gegen Desinfektionslösungen und ist somit eine mögliche Infektionsgefahr in der Klinik beim Einsatz von Implantaten.
Quellen
- ↑ Brennan PJ, Nikaido H: The envelope of mycobacteria. In: Annu. Rev. Biochem.. 64, 1995, S. 29–63. doi:10.1146/annurev.bi.64.070195.000333 . PMID 7574484 .
- ↑ a b Michael Rolle, Anton Mayr (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 7. Auflage. Enke Verlag, Stuttgart 1993, ISBN 3-432-84686-X
- ↑ P. J. Brennan: Mycobacterium and other actinomycetes. In: C. Ratledge, S. G. Wilkinson (Hrsg.): Microbial Lipids. Academic Press, London 1988, Bd. 1, S. 203-298.
- ↑ a b c d Sybe Hartmans, Jan de Bont, Erko Stackebrandt: The Genus Mycobacterium—Nonmedical In: The Prokaryotes, A Handbook of the Biology of Bacteria. 7 Bände, 3. Auflage, Springer-Verlag, New York u. a. O. 2006, Band 3: Archaea. Bacteria: Firmicutes, Actinomycetes. ISBN 0-387-25493-5
- ↑ a b c Jessup Shively: Inclusions in Prokaryotes, Springer-Verlag, 2006, ISBN 978-3-540-26205-3
- ↑ Tian J, Bryk R, Itoh M, Suematsu M, Nathan C: Variant tricarboxylic acid cycle in Mycobacterium tuberculosis: identification of alpha-ketoglutarate decarboxylase. In: Proc. Natl. Acad. Sci. USA. 102, Nr. 30, Juli 2005, S. 10670–5. doi:10.1073/pnas.0501605102 . PMID 16027371 . Volltext bei PMC: 1180764 .
- ↑ a b c d R. Schulze-Roebbecke (1993)
- ↑ F. Mba Medie, I. Ben Salah u.a.: Mycobacterium tuberculosis complex mycobacteria as amoeba-resistant organisms. In: PloS one. Band 6, Nummer 6, 2011, S. e20499. doi:10.1371/journal.pone.0020499 . PMID 21673985 . PMC 3108610 .
- ↑ a b c D. Schlossberg (2006)
- ↑ Alexander KA, Laver PN, Michel AL, et al.: Novel Mycobacterium tuberculosis complex pathogen, M. mungi. In: Emerging Infect. Dis.. 16, Nr. 8, August 2010, S. 1296–9. PMID 20678329.
- ↑ Hagedorn, M. et al.: Infection by tubercular mycobacteria is spread by nonlytic ejection from their amoeba hosts. In: Science. 323, Nr. 5922, 2009, S. 1729-1733. PMID 19325115 .
- ↑ a b Mario C. Raviglione (Hrsg.): Reichman and Hershfield’s tuberculosis: A comprehensive, international approach, Part B, Informa Healthcare, New York [u. a.] 2006, ISBN 0-8493-9271-3
- ↑ Wirth T, Hildebrand F, Allix-Béguec C, et al.: Origin, spread and demography of the Mycobacterium tuberculosis complex. In: PLoS Pathog.. 4, Nr. 9, 2008, S. e1000160. doi:10.1371/journal.ppat.1000160 . PMID 18802459 . Volltext bei PMC: 2528947 .
- ↑ a b Juan Carlos Palomino, Sylvia Cardoso Leão und Viviana Ritacco (2007) Online
Literatur
- Karl Bernhard Lehmann, Rudolf Otto Neumann: Atlas und Grundriss der Bakteriologie und Lehrbuch der speciellen bakteriologischen Diagnostik. Lehmann, München 1896.
- R. Schulze-Roebbecke: Mykobakterien in der Umwelt. In: Immunität und Infektion. Band 21, Heft 5, 1993
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes, 3. Auflage, Bd. 3: Archaea. Bacteria: Firmicutes, Actinomycetes. Springer Verlag, New York 2006, ISBN 978-0-387-25493-7 (Print), ISBN 978-0-387-30743-5 (Online)
- Juan Carlos Palomino, Sylvia Cardoso Leão, Viviana Ritacco: Tuberculosis 2007. Online
- D. Schlossberg: Tuberculosis & Nontuberculous Mycobacterial Infections. 5. Auflage, McGraw-Hill Publishing Company, 2006 ISBN 0-07-143913-7
- Hett EC, Rubin EJ: Bacterial growth and cell division: a mycobacterial perspective. In: Microbiol. Mol. Biol. Rev.. 72, Nr. 1, März 2008, S. 126–56, table of contents. doi:10.1128/MMBR.00028-07 . PMID 18322037 . Volltext bei PMC: 2268284 .
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Enterokokken
Enterokokken (eingedeutschter Plural aus dem latinisierten Singular Enterococcus, der sich aus den beiden altgriechischen Bestandteilen ἔντερον énteron ‚Darm‘, ‚Eingeweide‘ und κόκκος kókkos ‚Kern‘, ‚Korn‘ zusammensetzt)[1] sind Streptokokken der Serogruppe D[2] und werden zu den Milchsäurebakterien gerechnet. Sie kommen in der Umwelt, beim Tier und beim Menschen sowie in traditionellen Lebensmitteln wie Käse oder Rohwürsten vor.
Mikrobiologische Eigenschaften
Enterokokken sind grampositiv, Katalase-negativ und aufgrund des Fehlens von Porphyrinen und Cytochromen als aerotoleranter anaerober Keim eingestuft. Die kugelförmigen (kokkoiden) Bakterien sind in Paaren oder kurzen Ketten angeordnet.
Bei Menschen und Tieren spielen von den etwa 25 bekannten Enterokokken-Spezies zwei Arten, nämlich E. faecium und E. faecalis, eine wichtige Rolle im Verdauungssystem. Sie werden daher auch in probiotischen Lebensmitteln zur Förderung der Mikroflora des Verdauungssystems eingesetzt.
In Lebensmitteln spielen Enterokokken eine wichtige Rolle bei Fermentations- und Reifungsprozessen und tragen zum besonderen und gewünschten Geschmack der Lebensmittel (z. B. Büffel-Mozzarella, Camembert und Ziegenkäse) bei.
Weitere Spezies, die selten beim Mensch vorkommen können, sind E. durans sowie E. casseliflavus.[3]
Eigenschaften als Krankheitserreger
Neben ihren positiven Eigenschaften weisen bestimmte Enterokokken-Stämme (insbesondere bestimmte E. faecalis-Stämme) auch negative Wirkungen auf. Bei Menschen, deren Immunsystem stark geschwächt ist, können sie Infektionen auslösen. Die Zahl der Infektionen, an denen derartige Enterokokken-Stämme beteiligt sind, hat zugenommen. Sie sind bisher aber ausschließlich in Krankenhäusern beobachtet worden. Ein Zusammenhang zwischen diesen nosokomialen Infektionen und dem Verzehr von Lebensmitteln bzw. Probiotika ist bisher nicht nachgewiesen worden und gilt als unwahrscheinlich.
In den letzten Jahren werden sie zunehmend als Erreger zum Teil schwerer nosokomialer Infektionen isoliert. Sie sind vor allem als Ursache für Harnwegsinfekte, Sepsis und Endokarditis zu finden. Amoxicillin und Ampicillin sind zur antibiotischen Therapie geeignet, sofern keine Resistenzen gegen diese vorliegen. Gegen Cephalosporine und einige Penicilline besteht eine natürliche Resistenz. Besorgnis erregend ist das zunehmende Auftreten von Vancomycinresistenten Enterokokken (VRE), von denen erstmals 1988 berichtet wurde.[4] Heute sind VRE einer der häufigsten Gründe einer Bakteriämie bei Krankenhauspatienten nach Antibiotikabehandlung, insbesondere bei Krebspatienten nach einer Chemotherapie.[5] Vancomycinresistenz tritt am häufigsten bei Enterococcus faecium auf.
Literatur
- Constanze Wendt, Henning Rüden, Michael Edmond: Vancomycin-resistente Enterokokken. Epidemiologie, Risikofaktoren und Prävention. In: Deutsches Ärzteblatt. Köln, Jg. 95 (1998), Heft 25, ISSN 0012-1207 , S. A1604–A1611.
- Mathias Kolbert, Pramod M. Shah: Multiresistente Enterokokken. Epidemiologie, Risikofaktoren, Therapieoptionen. In: Arzneimitteltherapie. Jg. 17 (1999), Heft 4, ISSN 0723-6913 , S. 133 ff.
- G. Schulze, W. Schott, G. Hildebrandt: Vancomycin-resistente Enterokokken. Krankenhausküche als Vektor? In: Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz. Bd. 44 (2001), Heft 7, ISSN 0007-5914 , S. 732–737.
- Arne Simon, Nora Gröger, Steffen Engelhart, Ernst Molitor, Martin Exner, Udo Bode, Gudrun Fleischhack: Vancomycin-resistente Enterokokken (VRE). Übersicht zu Bedeutung, Prävention und Management in der Pädiatrie. In: Hygiene und Medizin. Jg. 29 (2004), Heft 7/8, ISSN 0172-3790 , S. 259 ff.
- Barbara Murray: Diversity among multidrug-resistant enterococci. In: Emerging Infectious Diseases. Jg. 4 (1998), S. 37–47.
Einzelnachweise
- ↑ Wilhelm Gemoll, Karl Vretska: Griechisch-Deutsches Schul- und Handwörterbuch. 10. Auflage. Oldenbourg, München 2010, ISBN 978-3-637-00234-0.
- ↑ Herbert Hof: Medizinische Mikrobiologie. 3. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-125313-4.
- ↑ Herbert Hof, Rüdiger Dörries: Duale Reihe Medizinische Mikrobiologie. 4. Auflage. Thieme, Stuttgart 2009, ISBN 978-3-13-125314-9, S. 330.
- ↑ Anne H. Uttley, C. Collins, Jay Naidoo, R. George: Vancomycinresistant enterococci (letter). In: The Lancet, Bd. 331 (1988), Heft 8575/8576, ISSN 0939-6217 , S. 57–58.
- ↑ Carles Ubeda, Ying Taur, Robert R. Jenq u. a.: Vancomycin-resistant Enterococcus domination of intestinal microbiota is enabled by antibiotic treatment in mice and precedes bloodstream invasion in humans. In: Journal of Clinical Investigation. Bd. 120 (2010), Heft 12, ISSN 0021-9738 , doi:10.1172/JCI43918 , S. 4332–4341.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Listerien
Listerien (ˌlɪsˈteːʀi̯ən) sind 0,4 × 1 bis 1,5 µm große stäbchenförmige, grampositive, nicht Sporen bildende, fakultativ anaerobe Bakterien der Gattung Listeria, benannt nach dem britischen Chirurgen Joseph Lister. Selten sind sie peritrich begeißelt und können somit schwimmen.
Wachstum
Listerien sind anspruchslos. Sie können sich in nährstoffarmen Substraten (Wasserpfützen, Kondenswasser) vermehren. Das optimale Wachstum erzielen sie im Temperaturbereich von 30 bis 37 °C, in einem pH-Bereich von 5,0 bis 9,0 und einer etwas erhöhten Kohlenstoffdioxidkonzentration. Sie sind aber auch im erweiterten Temperaturbereich von 4 bis 45 °C überlebens- und wachstumsfähig. Die Tatsache, dass sie kältetolerant sind, sowie ihre Fähigkeit, vom aeroben Stoffwechsel in einen anaeroben zu wechseln, befähigt sie, sich auch in vakuumverpackten Lebensmitteln (Fleischprodukte, Rohmilch, Käse, Räucherfisch), die im Kühlschrank liegen, zu vermehren.
Natürliches Vorkommen
Listerien sind in der Natur nahezu ubiquitär (allgegenwärtig) verbreitet und ernähren sich von totem organischem Material (Saprobier). Man trifft sie sowohl auf pflanzlichen Materialien (z. B. abgestorbenen Gräsern, Kopfpolsterstaub[1]) als auch im Darmtrakt von Menschen und Tieren (Schätzungsweise 1 bis 10 Prozent der Menschen tragen Listerien im Darm und scheiden sie mit dem Stuhl aus.)
Pathogenität
Listerien können bei Menschen und Tieren eine Infektionskrankheit verursachen, die Listeriose genannt wird. Als humanpathogen wird nur die Art Listeria monocytogenes angesehen. Die Infektion erfolgt durch Aufnahme von kontaminierter Nahrung, bei Tieren (hauptsächlich Rind u. Schaf) durch ungenügend angesäuerte Silage, beim Menschen durch den Verzehr von nicht sachgerecht hergestellten Lebensmitteln (vor allem Fleisch-, Fisch- und Milchprodukte). Listerien sind vor allem in nicht erhitzten tierischen Lebensmitteln (z. B. Rohmilch und Rohmilchkäse) enthalten. Pflanzliche Lebensmittel sind im Allgemeinen weniger betroffen. Listerien können aber durch Düngung mit tierischen Abwässern auf Gemüse gelangen.
Lebensmittelsicherheit
Trotz der ubiquitären Verbreitung der Listerien ist die Zahl der Erkrankungen überraschend niedrig, was am geringen Listerien-Gehalt (100 Bakterien je Gramm) liegen könnte. Durch die zunehmende industrielle Produktion von Lebensmitteln mit ihren vielen Zwischenstufen erhöhen sich aber die Kontaminations-Möglichkeiten. Dem versucht man durch entsprechende Hygiene-Maßnahmen zu begegnen.
Listeriose
Listeriose ist eine durch das Bakterium Listeria monocytogenes ausgelöste, meldepflichtige Krankheit.
Klinik
Eine Listeriose verläuft bei gesunden Menschen meist harmlos oder wird sogar kaum bemerkt. Werden besonders viele Erreger aufgenommen, kann es zu Fieber und Durchfällen kommen. Kleinkinder oder Menschen mit geschwächter Immunabwehr, wie frisch Operierte, Aids- oder Krebspatienten und Diabetiker können schwer erkranken.
Der Ausbruch der Erkrankung kann bis zu acht Wochen nach Aufnahme der Bakterien erfolgen. Listerien können Sepsen („Blutvergiftungen“) oder Meningitiden (Hirnhautentzündungen) verursachen, die mit Antibiotika behandelt werden können, aber dennoch in 30 Prozent der Fälle zum Tode führen.
Besonders bei Schwangeren ist eine Listeriose sehr gefährlich, da sie fatale Folgen für das ungeborene Kind haben kann. Es kann zu Frühgeburt, schweren Schädigungen oder sogar zum Absterben des Fötus kommen. Die Schwangere hingegen bemerkt die Erkrankung oft nicht einmal.
Aktuelles
Im Jahr 2010 wurden Listerien in Schimmelkäse und Harzerkäse des österreichischen Unternehmens xxx GmbH in Hartberg gefunden, angeboten vom Lebensmitteldiscounter xxx. Der Hersteller musste daraufhin die Produktionsanlagen vorübergehend stilllegen und reinigen.[2] Durch diese kontaminierten Käse kamen sechs Menschen in Deutschland und Österreich zu Tode.[3] In Gorgonzola-Käse vom Unternehmen xxx&xxx, angeboten vom Lebensmitteldiscounter xxx, wurden Listerien nachgewiesen. Betroffen waren xxx-Filialen in Niedersachsen, Nordrhein-Westfalen, Rheinland-Pfalz und Hessen.[4][5] Im August 2011 wurden in einer Salami des Lebensmitteldiscounter xxx Listerien nachgewiesen.[6]
Am 28. September 2011 wurden in Colorado 13 Tote und 72 Erkrankte an den Folgen eines Listerien-Ausbruchs gemeldet. [7]
Am 4. Dezember 2011 musste der Hersteller von xxx Milch weitere seiner Prokukte wegen Listerien zurückrufen, welche in vielen Geschäften in Deutschland und Österreich angeboten werden.[8]
Therapie
Ist eine Listeriose durch den Nachweis der Erreger diagnostiziert, wird der Betroffene mit Antibiotika behandelt. In 70 Prozent der Fälle kann so die Erkrankung gestoppt werden. Die Meningitis durch Listeria monocytogenes wird mit Aminopenicillinen (Ampicillin oder Amoxicillin), eventuell in Kombination mit Aminoglycosiden (Gentamicin) behandelt. Der direkte Nachweis der Listerien in Blut, Liquor cerebrospinalis oder Eiter gelingt nicht immer. Andere Testverfahren, wie etwa der Nachweis von Antikörpern im Blut, sind andererseits untauglich. Daraus folgt, dass viele Erkrankungen gar nicht erkannt werden.
Genomforschung
Im Jahr 2001 wurden im Rahmen eines von der EU finanzierten Forschungsprojektes die kompletten DNA-Basensequenzen des Genoms von Listeria monocytogenes und von Listeria innocua ermittelt, veröffentlicht und aus dem Vergleich der Daten umfangreiche neue Erkenntnisse über die Biologie und Evolution der Bakterien abgeleitet. Von den anderen Mitgliedern der Gattung Listeria werden gegenwärtig ebenfalls die DNA-Basensequenzen des kompletten Genoms ermittelt.
Publizierte Genomsequenzen:
- L. monocytogenes Sv1/2a
- L. innocua Sv6a
- L. monocytogenes Sv4b F2365
- L. monocytogenes Sv4b H7858, 178 contigs
- L. monocytogenes Sv1/2a F6854, 133 contigs
Ermittelte, aber noch nicht publizierte Genomsequenzen:
- L. welshimeri Sv6b
- L. seeligeri Sv1/2b
- L. monocytogenes Sv4a
- L. monocytogenes Sv4b
- L. ivanovii Sv5
Literatur
- P. Glaser, L. Frangeul u. a.: Comparative genomics of Listeria species. In: Science. Band 294, Nummer 5543, Oktober 2001, S. 849–852, ISSN 0036-8075 . doi:10.1126/science.1063447 . PMID 11679669 .
- J. A. Vázquez-Boland, M. Kuhn u. a.: Listeria pathogenesis and molecular virulence determinants. In: Clinical microbiology reviews. Band 14, Nummer 3, Juli 2001, S. 584–640, ISSN 0893-8512 . doi:10.1128/CMR.14.3.584-640.2001 . PMID 11432815 . PMC 88991 . (Review).
- M. Korthals, M. Ege u. a.: Occurrence of Listeria spp. in mattress dust of farm children in Bavaria. In: Environmental research. Band 107, Nummer 3, Juli 2008, S. 299–304, ISSN 1096-0953 . doi:10.1016/j.envres.2008.02.007 . PMID 18377890
Einzelnachweise
- ↑ Forscher der Technischen Universität München (TUM) haben die kleinen Krankmacher auch im Matratzenstaub von Bauernhofkindern gefunden. Möglicherweise sorgen die Mikroorganismen mit dafür, dass Kinder vom Bauernhof weniger an Allergien leiden als Kinder in der Stadt. „Occurrence of Listeria spp. in mattress dust of farm children in Bavaria.“ - [1]
- ↑ xxx warnt vor zwei Käsesorten Zeit.de: 17. Februar 2011, Abgerufen: 27. April 2011
- ↑ xxx und der tödliche Käse Stern.de: 17. Februar 2011, Abgerufen: 27. April 2011
- ↑ Listerien-Fund in Discounter Käse xxx.de: 25. April 2011, Abgerufen: 27. April 2011
- ↑ Rabe&Freunde 19. April 2011, Abgerufen: 27. April 2011
- ↑ [2]
- ↑ [3]
- ↑ Produktrückruf Bergkäse. Vom 4. Dezember 2011
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Listeriose
Die Listeriose ist eine durch Bakterien der Gattung Listeria verursachte Infektionskrankheit. Der wichtigste Erreger ist Listeria monocytogenes, der weltweit vorkommt und hochansteckend, aber nur von mäßiger krankheitsauslösender Wirkung ist.
Die Listeriose kommt beim Menschen vor allem bei Schwangeren und deren ungeborenen Kindern, sowie bei Neugeborenen, bei alten Menschen und bei Menschen mit einer abgeschwächten Immunabwehr (AIDS-Patienten, Immunsupprimierte) vor. Die Zahl der Listeriosen beim Menschen als Folge von Lebensmittelinfektionen – mit teils tödlichem Ausgang – ist in den letzten Jahren in Europa angestiegen. In der Tierwelt sind vor allem Wiederkäuer (Rinder, Schafe, Ziegen) betroffen. Selten betrifft es Vögel, Pferde und Schweine und sehr selten Raubtiere.
Für die Verbreitung der Erkrankung bei Mensch und Tier spielen vor allem verdorbene und verschmutzte Lebens- beziehungsweise Futtermittel eine Rolle, weshalb sie im klassischen Sinne keine Zoonose – eine vom Menschen auf Tiere und umgekehrt übertragbare Krankheit – sondern eher eine Fäulnis- (Sapronose) oder Erdkeiminfektion (Geonose) ist.
Das klinische Bild der Listeriose ist sehr variabel und hängt vor allem vom befallenen Organsystem ab. Daher ist die Erkrankung klinisch nicht sicher festzustellen, weshalb eine adäquate Behandlung mit wirksamen Antibiotika häufig zu spät erfolgt. Bei Lebensmittelinfektionen treten beim Menschen im Regelfall zunächst Durchfall und Bauchschmerzen auf. Am häufigsten entwickeln sich im weiteren Verlauf bei Mensch und Tier infolge einer Entzündung des Gehirns und der Hirnhäute zentralnervöse Störungen wie Lähmungen, Zittern, Körperfehlstellungen und Benommenheit. Bei Schwangeren und trächtigen Tieren kann es zu Fehlgeburten, Absterben des Fötus oder schweren Neugeboreneninfektionen (Septikämien) kommen. Schließlich kann sich eine Listeriose auch als lokale Wundinfektion sowie als Entzündung der Binde- und Hornhaut manifestieren.
Die Listeriose ist in Deutschland seit 2001 sowohl beim Menschen als auch bei Tieren eine meldepflichtige Krankheit (Infektionsschutzgesetz § 7, Verordnung über meldepflichtige Tierkrankheiten).
Erreger
Der häufigste Krankheitserreger ist Listeria monocytogenes, ein grampositives Stäbchen von 0,5 bis 2 µm Länge und 0,4 bis 0,5 µm Breite. Er bildet bei Temperaturen über 25 Grad Celsius Geißeln aus und ist dann beweglich. Er wächst auch unter Sauerstoffabschluss (fakultativ anaerob). Listeria monocytogenes ist außerordentlich kälteresistent und vermehrt sich noch bei Kühlschranktemperatur. Darüber hinaus ist es bis zu einem pH-Wert von 4,5 säureresistent und widersteht auch hohen Salzkonzentrationen.
Man unterscheidet sechs Serotypen. Die Virulenz des Erregers wird vor allem durch das Haemolysin-Gen (hly) bestimmt, welches das Protein Listeriolysin O (LLO) kodiert.[1] 90 % aller Infektionen des Menschen werden durch die Serotypen 4b, 1/2b und 1/2a ausgelöst.[2] In den Vereinigten Staaten und Finnland gibt es bereits Datenbanken, in denen die über Pulsfeldgelelektrophorese ermittelten genetischen Muster der Stämme von L. monocytogenes erfasst sind, so dass eine schnelle Aufklärung und Bekämpfung der Listeriosefälle möglich ist.[3]
Bei Schafen spielt darüber hinaus auch Listeria ivanovii eine Rolle, jedoch nur bei der Gebärmutterform (siehe unten). Andere Listerien sind nicht krankheitsauslösend (apathogen).[1]
Verbreitung
Listerien kommen praktisch überall (ubiquitär) vor. Sie gelten als Schmutzkeim und sind besonders in Abwässern, Böden, sowie verunreinigtem Wasser, Lebens- und Futtermitteln verbreitet. Da Listerien somit eher als Erd- oder Fäulniskeime anzusehen sind, wird die Erkrankung auch als „Geonose“ oder „Sapronose“ bezeichnet. Die direkte Ansteckung von Tier zu Tier, Tier zu Mensch oder von Mensch zu Tier findet praktisch nicht statt.
Die häufigsten Infektionsquellen für Wiederkäuer sind unzureichend vergorene oder erdreichverschmutzte Silage mit einem pH-Wert > 5,6 oder verdorbenes Heu.
So gut wie jedes mit Erde oder Staub kontaminierte Lebensmittel enthält Listerien, weshalb insbesondere Obst und Gemüse beziehungsweise pflanzliche Futtermittel für die Ansteckung verantwortlich sind. Ausnahmen stellen Karotten, Äpfel und Tomaten dar, in denen sich der Erreger nicht hält.
Lebensmittel tierischer Herkunft sind zumeist sekundär kontaminiert, werden also erst bei der Verarbeitung mit Listerien beimpft. Besonders gefährdet sind Rohmilch und Butter. Milchprodukte wie Hartkäse, Joghurt und Quark gelten dagegen als sicher. Die ordnungsgemäße Pasteurisierung tötet Listerien zuverlässig ab. Pasteurisierte Milch kann aber im Haushalt wieder kontaminiert werden, wodurch es auch bei Kühlschranklagerung zu einer Anreicherung mit Listerien kommen kann. Mayonnaise, Geflügelfleisch und kurzgereifte Rohwürste (Teewurst, Mettwurst) sind ebenfalls kritische Lebensmittel.[4] Vor allem auf den Oberflächen von Roh- und Weichkäsen und Salami können sich Listerien vermehren und Kolonien bilden. Da in solchen Fällen nur jene Menschen erkranken, die zufällig ein Stück mit Kolonien verzehren, andere, die das gleiche Lebensmittel auch essen, jedoch nicht, ist die Aufklärung hier besonders schwierig. Bei vakuumverpacktem Räucherlachs wurden Kontaminationsraten von bis zu 50 % festgestellt, wobei hier offenbar nur gering humanpathogene Stämme auftreten und Lebensmittelinfektionen durch Räucherlachs selten vorkommen.[3]
2006 wurden in Deutschland 520 Listeriosefälle beim Menschen registriert. In der jüngeren Zeit wurde dabei eine Zunahme der Listeriosefälle infolge von Lebensmittelinfektionen beobachtet, während die Anzahl der Neugeborenen- und Schwangereninfektionen (siehe unten) konstant blieb. Erstere stellen im Regelfall Einzelerkrankungen, zumeist bei älteren Menschen dar. Die Ursache für diese Zunahme ist nicht bekannt.[3] In den Vereinigten Staaten ist L. monocytogenes für 28 % der durch Lebensmittel verursachten Todesfälle verantwortlich.[4] Bei Tieren sind vor allem Rinder und Schafe betroffen, bei anderen Tieren spielt die Listeriose nur eine untergeordnete Rolle. Die Zahl der Ausbrüche in Rinder- und Schafherden zeigt in den letzten Jahren eine leicht fallende Tendenz.
Krankheitsentstehung
Die Ansteckung erfolgt über den Mund (oral) oder als Schmierinfektion bei Weichteilinfektionen. Der Erreger breitet sich bei Tieren vor allem über Lymphgefäße und entlang der Hirnnerven V (Nervus trigeminus) und XII (Nervus hypoglossus) aus.
Bei Menschen mit Abwehrschwäche hat L. monocytogenes die Fähigkeit, sich mittels bestimmter Oberflächenproteine (InlA, InlB und P60) an E-Cadherin zu binden und so in Epithelzellen des Magen-Darm-Kanals sowie Zellen anderer Organe einzudringen. Innerhalb der Zellen (intrazellulär) überlebt L. monocytogenes in membranumhüllten Vakuolen und ist so vor den Mechanismen der unspezifischen Abwehr geschützt, selbst in Makrophagen kann der Erreger dem intrazellulären Abbau widerstehen.[4]
Bei Vorhandensein bestimmter Virulenzfaktoren (Listeriolysin, Phospholipase) verlässt der Erreger diese Membranhüllen und vermehrt sich im Zytoplasma befallener Zellen. Dabei entstehen im Darm verstreut (disseminiert) Granulome („Listeriome“). Von diesen verteilt sich der Erreger über das Blut (Bakteriämie) und besiedelt andere Organe.[5] Listerien haben die Fähigkeit, sich an die Enden der Aktinfilamente des Zellgerüsts anzukoppeln und sich dadurch innerhalb der Zellen zu bewegen.[6] Da Aktinfilamente auch in bestimmte Zellkontakte einstrahlen, sind Listerien in der Lage, auch in Nachbarzellen einzudringen und überwinden so auch anatomische Barrieren wie die Blut-Hirn-Schranke und die Plazenta.[4]
Der Körper reagiert auf das Eindringen des Erregers mit einer Immunreaktion und entwickelt im Normalfall eine zelluläre Immunität. In infizierten, aber nicht erkrankten Lebewesen kann der Erreger in den Mandeln, im Magen-Darm-Trakt und in der Leber nachgewiesen werden. Zum Ausbruch der Krankheit kommt es im Regelfall nur bei einem geschwächten Immunsystem. Der Erreger benötigt also weitere Faktoren, um das Immunsystem zu überwinden und eine Erkrankung auszulösen (Faktorenkrankheit). Infizierte Tiere und Menschen scheiden den Erreger über den Kot und Laktierende auch über die Milch aus.
Listeriose bei Tieren
Wiederkäuer
Schafe und Ziegen
Bei Schafen und Ziegen kann die Listeriose in vier Formen auftreten, wobei die Erkrankung bei Ziegen zumeist dramatischer verläuft als bei Schafen.
Die häufigste Form ist die zentralnervöse Form, bei der es aufgrund einer Gehirn-Hirnhaut-Entzündung zu neurologischen Ausfällen kommt. Diese Form tritt vor allem bei 4 bis 6 Monate alten Lämmern auf und wird meistens durch L. monocytogenes Typ 4b verursacht. Typische Symptome sind Abgeschlagenheit, Drehbewegungen (im englischen Sprachraum heißt die Erkrankung daher auch circling disease), Herabhängen der Ohren, Zittern der Lippen, Augenzittern und im fortgeschrittenen Stadium Festliegen in Seitenlage mit Ruderbewegungen. Darüber hinaus sind häufig Tränen- und Nasenausfluss zu beobachten. Eine Halsüberstreckung ist eher selten, die Reflexe sind zumeist ungestört. Die Erkrankung endet gewöhnlich binnen 10 Tagen tödlich.
Die metrogene Form (v. griech. metra „Gebärmutter“) äußert sich in Fehlgeburten bei tragenden Mutterschafen. Die Fehlgeburten verlaufen in der Regel komplikationslos, also ohne Nachgeburtsverhaltung oder Endometritis. Auslöser ist zumeist L. ivanovii.
Die septikämische Form ist durch eine Erregerausbreitung im Blut gekennzeichnet (Septikämie) und tritt vor allem bei Lämmern in den ersten Lebenswochen auf. Sie ist durch Fieber, Schwäche, Saugunlust und Durchfall gekennzeichnet. Sie tritt in einer Herde meist nur sporadisch auf, endet für betroffene Tiere aber zumeist tödlich.
Die Augenform zeigt sich in einer Bindehaut- und Hornhautentzündung.
Differentialdiagnostisch kommen bei Schafen vor allem Bornasche Krankheit, Coenurose, Enterotoxämien, Tollwut, Pansenazidose, Trächtigkeitsketose, septikämische Meningitis, Abszesse des Gehirns und der Hirnhäute, Zerebrokortikalnekrose, Calcium- oder Magnesiummangel in Betracht. Auch Border Disease, Springkrankheit, Toxoplasmose, Scrapie, Visna, Kupfer-Vergiftung, Botulismus und Zeckenparalyse gehen mit zentralnervösen Erscheinungen einher. Aujeszkysche Krankheit und Bradsot verlaufen bei Schafen meist perakut und können so klinisch ausgeschlossen werden.
Rinder
Auch bei Rindern kommen verschiedene Formen vor, wobei die zentralnervöse und die metrogene Form dominieren. Septikämie, Keratokonjunktivitis und Euterentzündung treten vergleichsweise selten auf, sind aber aufgrund der Keimstreuung von Bedeutung.
Bei der zentralnervösen Listeriose gelangen die Erreger vermutlich über Schleimhautläsionen im Kopfbereich (z. B. im Zahnwechsel) entlang des Nervus trigeminus zum Hirnstamm. Durch eine meist einseitige Enzephalitis werden Kerngebiete von Hirnnerven geschädigt. Je nach beteiligten Hirnnerven kommt es zu meist einseitiger Lähmung der entsprechenden Muskeln. Durch Herabhängen der Augenlider kann sich eine Hornhautentzündung (sogenannte „Expositionskeratitis“) entwickeln, über den unvollständigen Lippenschluss und durch einen gestörten Schluckvorgang kommt es zum Verlust von Speichel. Aufgrund der Lähmungen im Kopfbereich werden die Futter- und Wasseraufnahme erheblich behindert, weshalb es bald zu Dehydratation sowie zur Eindickung von Panseninhalt und Kot kommt. Die Schädigung des Gleichgewichtssinnes führt zu Kopfschiefhaltung, Gegen-die-Wand-Drängen und später auch zum Festliegen. Unbehandelt führt diese Form der Listeriose innerhalb von 1–2 Wochen in der Regel zum Tod.
Listerien-bedingte Aborte, Tot- und Fehlgeburten treten experimentell etwa 7 Tage nach intravenöser Infektion auf. Etwa 10 % der spontanen Fälle gehen mit Nachgeburtsverhaltung einher.
Wild- und Zootiere
Auch bei in Gefangenschaft gehaltenen Wildwiederkäuern – vor allem Gabelbock, Grantgazelle, Hirschziegenantilope, Wildschafe und -ziegen; selten bei Hirschen – treten Listeriosen infolge von Verfütterung von verdorbenen Futtermitteln auf. Das Krankheitsbild gleicht dem der Hauswiederkäuer.[7]
Andere Tierarten
Bei Vögeln verläuft eine Listeriose zumeist als Septikämie mit unspezifischen Symptomen und plötzlichen Todesfällen. Am häufigsten sind Kanarienvögel und Wellensittiche betroffen, insgesamt ist die Erkrankung aber selten. Auch zentralnervöse Erscheinungen sind möglich.[8]
Bei Pferden und Schweinen treten gelegentlich zentralnervöse Erkrankungen oder Aborte auf. Bei Hunden und Katzen ist eine Listeriose sehr selten. Sie kann bei Hunden septikämisch, mit Aborten oder als zentralnervöse Form auftreten, allerdings meist nur bei Tieren mit gestörter T-Zell-Funktion, beispielsweise infolge einer Staupe.[9] Katzen zeigen vor allem einen septikämischen Verlauf mit Fressunlust, Abgeschlagenheit, Erbrechen und Durchfall, gelegentlich ist L. monocytogenes auch bei Wundinfektionen beteiligt.[10] Bei Hasenartigen und Nagetieren kann sich eine Listeriose in Form einer Enzephalitis mit zentralnervösen Symptomen manifestieren[8], bei Wasserschweinen wird auch die metrogene Form beobachtet.[7] Bei Affen treten Listeriosen am häufigsten bei Meerkatzenartigen, seltener bei Menschenaffen, Neuweltaffen und Galagos auf. Es dominieren – ähnlich wie beim Menschen – die zentralnervöse und metrogene Form mit Neugeboreneninfektion, darüber hinaus werden Leberentzündungen beobachtet.[7]
Reptilien sind zwar Träger von Listerien und scheiden diese aus, die Bedeutung als Auslöser von Krankheiten bei Reptilien selbst ist aber bislang ungeklärt.[8] Es gibt einen gesicherten Fall eines septikämischen Verlaufs bei einer Bartagame nach Verfütterung von listerienhaltigem Schweinefleisch, der nach drei Tagen mit Mikroabszessen in verschiedenen inneren Organen tödlich endete.[11]
Veterinärpathologie
Veterinärpathologisch lassen sich bei der zentralnervösen Form Ansammlungen von weißen Blutkörperchen im Gehirngewebe (leukozytäre Infiltrate) und eine Hirnhautentzündung mit Ansammlung von Lymphozyten (lymphozytäre Meningitis nachweisen. Je nach Pathogenität des Erregers kommt es auch zu abszedierenden, nekrotisch-eitrigen oder granulomatösen Prozessen. Sie betrifft vor allem den Hirnstamm und den Halsteil des Rückenmarks. Relativ typisch ist bei Schafen ein trockener Panseninhalt.
Septikämische Formen äußern sich in hirsekorngroßen (miliaren) Nekrosen in Leber und Lunge sowie Blutungen unter die Herzinnenhaut (subendokardial) und den Herzüberzug (subepikardial).
Die metrogene Form zeigt sich in Nekrosen der Plazenta, bei Wiederkäuern im Bereich der Kotyledonen.
Listeriose bei Menschen
Listeriose bei Immunkompetenten
Die Listeriose ist bei immunkompetenten Personen selten und die Infektion verläuft meistens symptomlos (inapparent). L. monocytogenes kann im Magen-Darm-Trakt persistieren, ohne klinische Erscheinungen auszulösen. In Einzelfällen kann es zu einer grippeähnlichen Symptomatik kommen, die aber selbstlimitierend und damit nicht therapiebedürftig ist. Neuere Studien weisen jedoch darauf hin, dass sich nach Verzehr von stark mit Listerien angereicherten Lebensmitteln binnen 24 Stunden auch bei sonst gesunden Menschen eine schwere Magen-Darm-Entzündung (Gastroenteritis) einstellen kann.[1] Die Listeriose beginnt beim Menschen vermutlich immer mit einer Gastroenteritis mit Bauchschmerz und Durchfall. Da hier vielfältige Ursachen vorliegen können, wird diese häufig nicht ausdiagnostiziert und gezielt therapiert. Sekundär entstehende Krankheitsbilder können bis zu einige Wochen später auftreten und werden deshalb häufig nicht mehr mit diesem Ereignis in Verbindung gebracht.[4] Die Listeriose zählt nach der Berufskrankheiten-Verordnung zu den Berufskrankheiten in der Landwirtschaft und Lebensmittelindustrie, obwohl diese Exposition epidemiologisch kaum Bedeutung hat, sondern nur bei lokalen Haut- und Bindehautinfektionen eine Rolle spielt.
Listeriose bei Immuninkompetenten
Bei einer Immunsuppression erhöht sich generell das Risiko einer Infektion. Eine Immunsuppression ist meist erworben z. B.: durch eine Virusinfektionen (HIV), durch eine immunsuppressive Therapie mittels Zytostatika oder Glucocorticoiden, welche nach einer Organtransplantation oder im Rahmen einer Autoimmunkrankheit oder bei einer Blutkrebserkrankung (Leukämie) eingesetzt werden. Auch chronischer Alkoholmissbrauch führt zu einer Art Immunsuppression. Die natürliche, altersbedingte Immunsuppression prädispositioniert ebenso für eine Infektion.
Eine Listeriose bei immunsupprimierten Personen ist sehr oft eine schwere, lebensbedrohliche Erkrankung. Es kommt gehäuft zu einem Befall mehrerer Organe. Die häufigste Manifestation, bei etwa einem Drittel der immungeschwächten Personen sowie Alkoholikern und älteren Menschen, ist eine Meningoenzephalitis, die sich am häufigsten im Hirnstamm manifestiert.[12] Bei Patienten mit Leberzirrhose kann eine Bauchfellentzündung auftreten. Schwere Fälle sind akut lebensbedrohlich. Bei einer Blutvergiftung kommt es zu einer hämatogenen Streuung der Listerien und folglich zur eitrigen Entzündung anderer Organe (Herzklappen, Gelenke, Knochen, Gallenblase), bei 12 % der Patienten zu einem septischen Schock.[3][13]
Seltener ist eine Angina mit Lymphknotenschwellungen mit Zunahme lymphomonozytärer Zellen im Blutbild. Diese Symptomatik wird als so genanntes „Pseudo-Pfeiffer“ (Paul-Bunnell-negative infektiöse Mononukleose) bezeichnet.[5]
Bei Schmierinfektion der Bindehaut kann sich eine Bindehautentzündung, Hornhautentzündung oder Uveitis einstellen. Auch lokal begrenzte Hautinfektionen können auftreten.
Listeriose bei Schwangeren und Neugeborenen
Schwangere haben ein etwa 12-fach höheres Risiko, an einer Listeriose zu erkranken.[14] Sie äußert sich in der Regel nur als grippeähnlicher kurzer Fieberschub, der zumeist nicht ernst genommen wird. Jedoch kann sich eine Entzündung des Mutterkuchens (Plazentitis) einstellen und die Infektion auf das ungeborene Kind übergehen (konnatale Infektion durch diaplazentare Übertragung). Bei Infektionen in der frühen Schwangerschaft, erstes Trimenon, stirbt der Fötus meist ab und es kommt zum Abort. Spätere Infektionen, zweites und drittes Trimenon, führen zu einer intrauterinen Listeriose, welche zum Fruchttod und damit zum Spätabort führen kann oder eine Frühgeburt verursacht. Bei einer perinatalen Infektion kann sich das Bild einer Listeriosis infantiseptica entwickeln. Das Neugeborene kann direkt nach der Geburt Symptome zeigen (early-onset), oder erst nach Tagen bis zu vier Wochen danach, dies wird als late-onset bezeichnet. Trotz Intensivmedizin hat die „early-onset“ Erkrankung eine sehr schlechte Prognose, häufig kommt es zu einer Sepsis (Blutvergiftung), Meningitis (Hirnhautentzündung) und Pneumonie (Lungenentzündung). Die Letalität beträgt 36 %. Bei „late-onset“ Infektion erwirbt das Kind die Listerien meist während des Geburtsvorgangs. Die Erkrankung äußert sich meistens als Hirnhautentzündung. Bei einer geeigneten Therapie ist hier die Prognose besser, die Letalität beträgt 26 %.[3]
Differentialdiagnostisch kommen beim Menschen eine Vielzahl von Erkrankungen in Betracht: Durchfall anderer Genese, Virusinfekte wie Pfeiffer-Drüsenfieber sowie Sepsis, Meningitis und Enzephalitis durch andere Erreger.
Diagnose
Die Diagnose ist klinisch kaum sicherzustellen. Im Blutbild zeigt sich ein Anstieg des Gehalts an weißen Blutkörperchen (Leukozytose). Die Untersuchung des Gehirnwassers (Liquor cerebrospinalis) zeigt eine Pleozytose mit vermehrter Zahl mononukleärer Zellen. Auch das pathologische Bild ist nicht charakteristisch. Serologische Untersuchungen, also Antikörpernachweise haben keinerlei Aussagekraft.
Nur eine bakteriologische Untersuchung kann die Diagnose endgültig sichern. Die Erregeranzüchtung ist normalerweise problemlos, aus dem Gehirnwasser oder Proben mit starker Beteiligung anderer Bakterien (Kot, Vaginalsekret) gelingt sie jedoch nicht immer. Hier können molekularbiologische Methoden (DNA-Nachweis durch Polymerase-Kettenreaktion) weiterhelfen, insbesondere kann die DNA der Bakterien auf diese Weise sehr zuverlässig im Liquor cerebrospinalis nachgewiesen werden. Außerdem ist es bei Verdacht auf Listeriose grundsätzlich sinnvoll, Blutkulturen zu entnehmen, da der Erreger daraus in vielen Fällen angezüchtet werden kann.
Bei einer Hirnhautentzündung ergibt sich der Verdacht auf eine Listeriose in der Regel schon aus dem Nachweis grampositiver Stäbchen im Liquor cerebrospinalis. Dabei handelt es sich fast immer um Listerien.
Behandlung
Das größte Problem der Therapie ist, dass kaum rechtzeitig eine sichere Diagnose gestellt werden kann, da der Erregernachweis nicht immer gelingt. L. monocytogenes ist zwar empfindlich gegenüber vielen Antibiotika wie Ampicillin, Amoxicillin, Erythromycin, Gentamicin und Sulfonamiden, aufgrund der unklaren Symptomatik beginnt die Behandlung aber häufig zu spät. Ein weiteres Problem der Therapie ist, dass der Erreger fakultativ intrazellulär vorkommt, wo er für einige Antibiotika nicht angreifbar ist. Darüber hinaus sind die Patienten in der Regel immungeschwächt, so dass körpereigene Abwehrmechanismen die medikamentelle Therapie nur unzureichend unterstützen.
Problematisch ist weiterhin, dass Cephalosporine – eine Gruppe häufig routinemäßig eingesetzter und eigentlich breit wirksamer Antibiotika – keine Wirksamkeit gegen Listerien zeigen. In einer spanischen Studie starben 50 % der Patienten, bei denen empirisch Cephalosporine eingesetzt wurden, jedoch nur 12 %, wenn ein listerienwirksames Antibiotikum angewendet wurde.[13] Nach anderen Angaben liegt die Mortalität trotz frühzeitiger Behandlung und dem Einsatz wirksamer Antibiotika zwischen 20 und 30 %.[3]
Als Therapie der Wahl gilt die Behandlung mit Ampicillin, das bis zu sechsmal täglich über 14 bis 21 Tage verabreicht wird, bei schwerer Meningitis in Kombination mit Gentamicin. Bei Unverträglichkeit gegenüber β-Lactam-Antibiotika wird Erythromycin eingesetzt.[5]
Vorbeugung
Die sicherste Prophylaxe vor Lebensmittelinfektionen beim Menschen ist das ausreichende Erhitzen. Gemüse sollte sorgfältig gewaschen und getrennt von rohem Fleisch gelagert werden. Hände, Messer und Flächen sollten nach Kontakt mit rohem Fleisch oder Gemüse gut gewaschen werden. Personen mit erhöhtem Krankheitsrisiko wie Schwangere, Ältere und Schwerkranke sollten rohes Fleisch, rohen Fisch (Lachs), Rohmilch und Rohmilchprodukte wie Rohmilchkäse grundsätzlich meiden und Fertiggerichte kurz vor dem Verzehr noch einmal erhitzen.[4]
Bei Tieren sind die Vermeidung der Verfütterung verschmutzter Futtermittel, verdorbenen Heus oder fehlgegorener Silagen sowie die Vermeidung von Stress und anderer das Immunsystem schwächender Faktoren die wirksamsten Vorsorgemaßnahmen.
Geschichte
Die Krankheit wurde erstmals 1923 von Everitt George Dunne Murray und Mitarbeitern bei Kaninchen und Meerschweinchen in einer Versuchstierzucht in Cambridge beschrieben. Drei Jahre später wurde von Murray der Erreger isoliert und wegen der hohen Monozytose bei Kaninchen und Meerschweinchen zunächst Bacterium monocytogenes genannt.
1929 wurde in Dänemark der erste durch Erregeranzüchtung nachgewiesene Fall bei Menschen von Nyfeldt dokumentiert. Der erste Bericht bei Schafen wurde 1931 von Gill aus Neuseeland vorgelegt, 1941 wurde durch Georg Pallaske die Krankheit bei Hühnern in Deutschland nachgewiesen. Es folgten Nachweise bei Rindern in den USA (Johns und Little, 1935) und Schweinen (Biester und Schwarte, 1940).
1940 wurde der Erreger auf Vorschlag von J.H.H. Pirie nach dem britischen Naturwissenschaftler Joseph Lister, 1. Baron Lister, in Listeria monocytogenes umbenannt.
Die Listeriose blieb als Krankheit zunächst unbeachtet und der Erregernachweis galt eher als labordiagnostisches Kuriosum. 1952 erkannte Jürgen Potel vom Hygieneinstitut der Universität Halle die Bedeutung von L. monocytogenes für die Neugeborenenform (Granulomatosis infantiseptica).[15] Mit der Entwicklung wirksamer immunsuppressiver Medikamente ab den 1950er- und 1960er-Jahren erlangte die Listeriose zunehmend klinische Bedeutung beim Menschen.[16] Mit der Aids-Epidemie in den 1980er-Jahren stiegen auch die Listeriosefälle an, da Aids-Patienten ein 500-fach erhöhtes Erkrankungsrisiko haben.[17]
Die Erkenntnis, dass die Listeriose bei Tieren eine Futtermittelinfektion ist, legte den Verdacht nahe, Lebensmittel auch als Infektionsquelle für den Menschen in Betracht zu ziehen. Mit dem ersten Nachweis einer durch kontaminierte Nahrungsmittel verursachten Endemie 1981 in Halifax (Kanada) wurde diese These bewiesen. Bei dieser war kontaminierter Weißkrautsalat der Auslöser – mit 41 Betroffenen, davon 83 % Schwangere, und 17 Todesfällen. Weitere Endemien gab es in Le Vaud (Schweiz) (1983–1984 mit 57 Betroffenen durch Weichkäse, Mortalität 32 %), 1985 in Kalifornien mit 142 Betroffenen und 48 Todesfällen durch Verzehr von mexikanischem Käse, 1992 (38 Fälle, Mortalität 32 %) und 1999 (32 Fälle, Mortalität 31 %) in Frankreich durch Schweinefleisch sowie 1998/99 in den Vereinigten Staaten durch Hot Dogs mit 101 Betroffenen und einer Mortalität von 21 %. Zahlreiche Betroffene (1566), allerdings ohne Todesfälle, hatte eine Lebensmittelinfektion durch Maissalat in Italien 1997.[18]
Im August 2008 starben in Kanada acht Menschen nachweislich an Listeriose durch Verzehr von verseuchtem Fleisch, welches in Fertiggerichten von Maple Leaf Foods – einem der größten Hersteller in Kanada – enthalten war. Ursache waren hygienische Mängel im Werk in Toronto, welches von den kanadischen Behörden geschlossen wurde.[19]
In Deutschland und Österreich starben Ende 2009 acht Menschen nach dem Verzehr von mit Listerien belastetem Harzer Käse.[20]
Nach dem Tod von mindestens fünf Menschen durch Listeriose wurde in Texas/USA im Oktober 2010 eine Gemüsefabrik geschlossen. Im von der Fabrik verarbeiteten Sellerie wurden Listerien nachgewiesen.[21]
Ebenfalls in den Vereinigten Staaten kam es zwischen Juli und September 2011 zur Infektion mit Listerien durch verseuchte Melonen. 13 Menschen starben, Dutzende weitere erkrankten. Die Melonen stammten aus einer Fabrik in der Nähe von Denver, auf deren Produktionsmaschinen und gelagerten Melonen ebenfalls Listerien nachgewiesen werden konnten.[22]
Literatur und Quellen
- Heinrich Behrens et al. (Hrsg.): Schafkrankheiten. 4. Auflage. Paul-Parey-Verlag, 2001, ISBN 3-8263-3186-9.
- Hartwig Bostedt und Kurt Dedie: Schaf-und Ziegenkrankheiten. 2. Auflage. UTB Stuttgart, 1995, ISBN 3-8252-8008-X.
- M. Hamon et al.: Listeria monocytogenes: a multifaceted model.. In: Nature Reviews. Microbiology. Nr. 4(6), 2006, ISSN 1740-1526 , S. 423–434.
- H.-J. Selbitz: Listeria. In: Anton Mayr (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 7. Auflage. Enke-Verlag Stuttgart, 2002, ISBN 3-7773-1795-0, S. 509–517.
- Matthaeus Stöber: Listeriose. In: Gerrit Dirksen et. al (Hrsg.): Innere Medizin und Chirurgie des Rindes. 4. Auflage. Verlag Parey, Berlin 2002, ISBN 3-8263-3181-8, S. 1239–1244.
- W. Köhler et al.: Medizinische Mikrobiologie. 8. Auflage. Urban & Fischer-Verlag München/Jena, 2001, ISBN 3-437-41640-5.
Einzelnachweise
- ↑ a b c Pascale Cossart: Listeriology (1926–2007): the rise of a model pathogen. In: Microbes Infect. 2007 May 6, PMID 17618157 .
- ↑ J. M. Farber und P. J. Peterkin: Listeria monocytogenes, a food-borne pathogen. In: Microbiological Reviews. 1991; 55: 476–511.
- ↑ a b c d e f H. Hof et al.: Epidemiologie der Listeriose in Deutschland – im Wandel und dennoch nicht beachtet. In: Dtsch Med Wochenschr. 2007 Jun 15;132(24):1343–1348, PMID 17551889 .
- ↑ a b c d e f Robert-Koch-Institut: Epidemiologisches Bulletin. 8. Dezember 2006/Nr. 49, pdf .
- ↑ a b c H.-W. Baenkler (Hrsg.): Listeriose. In: Innere Medizin. Thieme-Verlag 2001, S. 1226–1227, ISBN 3-13-128751-9.
- ↑ Shenoy et al.: A kinematic description of the trajectories of Listeria monocytogenes propelled by actin comet tails. PNAS 2007;104(20):8229-34. PMID 17485664
- ↑ a b c Reinhard Göltenboth und Heinz-Georg Klös: Krankheiten der Zoo- und Wildtiere. Parey-Verlag 1995, ISBN 3-8263-3019-6
- ↑ a b c K. Gabrisch und P. Zwart: Krankheiten der Heimtiere. Schlütersche Verlagsgesellschaft Hannover, 6. Aufl. 2005, ISBN 3-89993-010-X.
- ↑ Katrin Hartmann: Listeriose. In: Peter F. Suter und Hans G. Niemand (Hrsg.): Praktikum der Hundeklinik. Paul-Parey-Verlag, 10. Auflage 2006, S. 308–309, ISBN 3-8304-4141-X.
- ↑ Reinhard Weiss: Listeriose. In: Marian C. Horzinek et al. (Hrsg.): Krankheiten der Katze. Enke-Verlag Stuttgart, 4. Auflage 2005, S. 172–173, ISBN 3-8304-1049-2.
- ↑ Elliot R. Jacobson: Bacterial diseases of reptiles. In: Elliot R. Jacobson (Ed.). Infectious diseases and pathology of reptiles. CRC Press 2007, S. 461–526, ISBN 0-8493-2321-5
- ↑ E. A. Antal et al.: Neuropathological findings in 9 cases of listeria monocytogenes brain stem encephalitis. In: Brain Pathol. 2005;15(3):187–91, PMID 16196384 .
- ↑ a b M. M. Suárez et al.: Listeria monocytogenes bacteremia: analysis of 110 episodes. In: Med Clin (Barc). 2007;129(6):218–21, PMID 17678604 .
- ↑ H. Hof: Kapitel 29: Listeria monocytogenes und andere Listerien. In: D. Adam et al. (Hrsg). Die Infektiologie. Springer Verlag, Berlin 2004, S. 945–952.
- ↑ J. Potel: Zur Granulomatosis infantiseptica. In: Zentral Bakteriol. I Orig 1952; 158:329–331.
- ↑ D. B. Louria et al.: Listeriosis complicating malignant disease: a new association. In: Ann Intern Med. 1967; 67:260–281.
- ↑ R. L. Jurado et al.: Increased risk of meningitis and bacteremia due to Listeria monocytogenes in patients with human immunodeficiency virus infection In: Clinical Infectious Diseases. 1993; 17:224–227.
- ↑ Walter F. Schlech III: Foodborne Listeriosis. In: Clinical Infectious Diseases. 2000;31:770–775, PMID 11017828 .
- ↑ DTÄBl. 56 (2008), S. 1402
- ↑ Gesetzesänderung nach acht Listeria-Toten. Agrar heute, 24. März 2010, abgerufen am 14. April 2010.
- ↑ DSHS Orders Sangar Produce to Close, Recall Products. Texas Department of Health Services, 20. Oktober 2010, abgerufen am 22. Oktober 2010.
- ↑ Listerien-Infektion: 13 Amerikaner sterben durch verseuchte Melonen. Spiegel Online, 28. September 2011, abgerufen am 28. September 2011.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Staphylokokken
Staphylococcus, der sich aus den beiden altgriechischen Bestandteilen σταφυλή staphylé ‚Weintraube‘ und κόκκος kókkos ‚Kern‘, ‚Korn‘ zusammensetzt)[1] sind rundliche, weintraubenähnlich angeordnete, nicht sporenbildende grampositive Bakterien ohne aktive Bewegung aus der Gruppe der Kokken.
Eigenschaften
Kugelförmige Zellen, Durchmesser 0,5 - 1,5 µm, einzeln, in Paaren oder in unregelmäßigen (weintraubenähnlichen) Haufen angeordnet, grampositiv, nicht motil (keine aktive Bewegung), fakultativ anaerob, chemoorganotroph, Energiestoffwechsel oxydativ und fermentativ, meistens Katalase-positiv und Oxidase-negativ. Temperaturoptimum des Wachstums und der Vermehrung 30-37 °C.[2] Viele Arten weisen einen hohen bis überwiegenden Anteil von verzweigten Fettsäureketten in ihren Membranlipiden auf.[3]
Vorkommen
Sie besiedeln als Kommensalen und Krankheitserreger (Pathogene) die Haut und Schleimhäute von Menschen und warmblütigen Wirbeltieren und kommen auch in der Umwelt (Gewässer, Luft, Lebensmittel) vor.
Systematik
Sie wurden ehemals zur Familie Micrococcaceae gerechnet, aktuell wurde in der neuen Auflage des BERGEY’S MANUAL of Systematic Bacteriology, 2. Edition vorgeschlagen, sie in eine neue Familie der „Staphylococcaceae“ einzuordnen, die fakultativ anaerob (Ausnahme: Staphylococcus aureus subsp. anaerobius, eine an Schafe angepasste [schafadaptierte] obligat anaerobe Subspezies) wachsen.
Einteilung, medizinische Bedeutung
In der Medizin erfolgt eine Einteilung der Staphylokokken nach der Koagulase-Reaktion in koagulasepositive (in der Humanmedizin meist mit Staphylococcus aureus gleichgesetzt) und koagulasenegative Staphylokokken.
Koagulasepositive Staphylokokken
Die Staphylokokken-Spezies mit der höchsten pathogenen Potenz sowie generell einer der bedeutendsten Krankheitserreger beim Menschen ist die koagulasepositive Spezies:
- Staphylococcus aureus (ganz korrekt: Staphylococcus aureus subsp. aureus)
Bisher ausschließlich bei Tieren bzw. nur sehr selten im Zusammenhang mit Infektionen beim Menschen nachgewiesen:
- Staphylococcus aureus subsp. anaerobius
- Staphylococcus delphini
- Staphylococcus hyicus (koagulasevariabel)
- Staphylococcus intermedius (selten – insbes. nach Hundebissen – auch bei menschlichen Wundinfektionen)
- Staphylococcus lutrae
- Staphylococcus pseudintermedius
- Staphylococcus schleiferi subsp. coagulans
Koagulasenegative Staphylokokken
Die koagulasenegativen Staphylokokken sind in der Regel Besiedler der Haut- und Schleimhäute ohne Krankheitsbedeutung. Jedoch bei immunsupprimierten Patienten (also solchen, bei denen mit Medikamenten die Abwehrfunktion des Immunsystems herabgesetzt worden ist, wie z. B. nach einer Transplantation, oder aber eine Krankheit das Immunsystem geschwächt hat) und im Zusammenhang mit sog. Polymer-assoziierten Infektionen, d. h. einer Besiedlung von Kunststoffoberflächen (z. B. Katheter, künstliche Herzklappen, künstliche Gelenke; siehe Biofilm), besitzen die koagulasenegativen Staphylokokken medizinische Bedeutung. Hiervon können beim Menschen insbesondere folgende Spezies in Erscheinung treten:
- Staphylococcus epidermidis
- Staphylococcus haemolyticus
- Staphylococcus lugdunensis
- Staphylococcus saprophyticus subsp. saprophyticus
Letztere ist eine weitere koagulasenegative Spezies, die allerdings mit einem spezifischen Krankheitsbild verbunden (assoziiert) ist. Dieser Erreger kann für das Dysurie-Syndrom bei jüngeren Frauen sowie auch für unspezifische Harnröhrenentzündungen (Urethritiden) bei Männern verantwortlich sein.
Methicillin-resistente Staphylokokken (MRSA)
Das sind die für den Menschen am gefährlichsten gewordenen Stämme, da sie durch den Erwerb eines zusätzlichen Penicillin-Bindeproteins (PBP2'), das von dem mecA-Gen codiert wird, nicht mehr mit beta-Lactamantibiotika (Oxacillin, Methicillin) bekämpft werden können. Darüber hinaus besitzen diese Stämme oftmals weitere Resistenzen gegen verschiedene Antibiotikaklassen (siehe Antibiotikum-Resistenz). Es besteht der Verdacht, dass sich diese Resistenzen besonders auf Grund der unkontrollierten Anwendung der genannten Antibiotika in der Massentierhaltung entwickelt haben.
Bisher traten diese resistenten Stämme vor allem in Krankenhäusern auf und verbreiten sich oft epidemieartig durch unzureichende Hygienemaßnahmen.
Community acquired (in der Bevölkerung erworbene) MRSA, kurz cMRSA
cMRSA sind Erreger aus der Gruppe der Methicillin-resistenten Staphylokokken, die allerdings vorwiegend außerhalb von Kliniken auftreten. Ihre Resistenzen sind weniger stark ausgeprägt als die der oben beschriebenen „normalen“ MRSA-Keime. Sie können neben reinen Besiedlungen auch Abszesse und nekrotisierende Pneumonien mit hoher Sterblichkeit verursachen.
Neuere Untersuchungen in den USA haben ergeben, dass sie doch schon weiter verbreitet sind als zuvor angenommen (Atlanta – 25,7 pro 100 000 Einwohner; Baltimore – 18 pro 100 000 Einwohner). In Europa treten diese Erregerarten noch nicht so häufig auf. Sie lassen sich momentan noch mit mehreren Antibiotika bekämpfen, die nur für die Bekämpfung sonst therapieresistenter Stämme ausschließlich beim Menschen verwendet werden sollten.
Wirkungscharakter
Vergiftung, hervorgerufen durch Enterotoxine, die vom Erreger als Metaboliten in das umgebende Substrat ausgeschieden werden. Die Toxine sind eiweißartiger Struktur mit molaren Massen von 20.000-40.000 g·mol-1. Das Enterotoxine B z.B. besteht aus einer einzelnen Polypeptidkette, in der 239 Aminosäurereste aneinandergereiht sind. Die Toxine lassen sich durch ihr immunbiologisches Verhalten gegeneinander abgrenzen. Das Enterotoxin A verursacht in Dosen von nur 1 µg beim Erwachsenen Erbrechen, das Enterotoxin B nach 20 bis 25 ng. Erste Symptome zeigen sich durchschnittlich zwei bis vier Stunden nach Aufnahme einer entsprechenden Toxin-Menge mit dem Lebensmittel, wobei die Variationsbreite zwischen einer halben und sieben Stunden liegt. Der primäre Angriffspunkt für die emetische Wirkung liegt in den Bauchorganen, über den Vagus und sympathische Fasern erreicht es das Brechzentrum. Andere Angriffspunkte für das Toxin sind Nieren, Leber, Lunge, Gastrointestinaltrakt, verschiedene Gewebe und einzelne Zellen.[4]
Symptome
Zunächst Salivation, dann Übelkeit, Würgen, Erbrechen, Durchfall. Erbrechen und Durchfall können gleichzeitig explosionsartig erfolgen. In schweren Fällen kann es zu Exsikkose, Schockzuständen, zum Auftreten von Schleim und Blut in Stuhl und Erbrochenem und hypokaliämischen Muskellähmungen kommen. Die Körpertemperatur ist in der Regel nicht erhöht, vielfach werden subnormale Temperaturen gemessen. Die Restitution kann innerhalb 24 Stunden eintreten oder auch einige Tage in Anspruch nehmen. Nur selten kommt es zum Exitus, hier meistens bei Neugeborenen. Mit der gewebeschädigenden Wirkung des Toxins steht der rasche Anstieg der GOT-Aktivität im Blutserum in Zusammenhang, ebenso wie die Veränderungen des weißen Blutbildes (Leukozytose bereits 30 Minuten nach peroraler Aufnahme, bei höheren Dosen mit vorhergehender Leukopenie, später deutliche Linksverschiebung), Katecholamin- und Glukoseanstieg, Erhöhung von Rest-N, Plasmafibrinogen und anorganischem Phosphor, Abfall von Serumprotein, Calcium und Chlor sowie schließlich Verminderung der Thrombozytenzahl und des Serotonins.[5]
Neue Forschungsansätze
Ein kalifornisches Forschungsteam aus Ärzten und Molekularbiologen der University of California, San Diego und des Children’s Hospital and Health Center in San Diego (USA) unter der Leitung von George Liu haben 2005 eine "Geheimwaffe" des Bakteriums entdeckt. Sie analysierten die Bestandteile der goldschimmernden Oberfläche des Bakteriums, die ihm auch den Namen aureus verliehen hatte, und fanden Farbpigmente aus der Gruppe der Carotinoiden. Diese Pigmente wirken als Antioxidationsmittel und unterbinden chemische Reaktionen mit Sauerstoff oder anderen oxidierenden Substanzen. So schützt sich das Bakterium vor einigen Stoffen, die ein Immunsystem zur Abwehr nutzt. Weiße Blutkörperchen setzen z. B. Sauerstoff gegen Krankheitserreger ein. Möglicherweise wird ein Wirkstoff entwickelt, der die Entstehung dieser Pigmente verhindert und nunmehr die Abwehr durch körpereigene Stoffe ermöglicht.[6]
Spezies (Arten) und Subspezies (Unterarten) der Gattung Staphylococcus
- S. arlettae Schleifer et al. 1985
- S. aureus Rosenbach 1884
- S. aureus subsp. anaerobius De La Fuente et al. 1985
- S. aureus subsp. aureus Rosenbach 1884
- S. auricularis Kloos and Schleifer 1983
- S. capitis Kloos & Schleifer 1975
- S. capitis subsp. capitis Kloos and Schleifer 1975
- S. capitis subsp. urealyticus corrig. Bannerman and Kloos 1991
- S. caprae Devriese et al. 1983 emend. Kawamura et al. 1998
- S. carnosus Schleifer and Fischer 1982
- S. carnosus subsp. carnosus Schleifer and Fischer 1982
- S. carnosus subsp. utilis Probst et al. 1998
- S. chromogenes (Devriese et al. 1978) Hájek et al. 1987
- S. cohnii Schleifer and Kloos 1975
- S. cohnii subsp. cohnii Schleifer and Kloos 1975
- S. cohnii subsp. urealyticus corrig. Kloos and Wolfshohl 1991
- S. condimenti Probst et al. 1998
- S. delphini Varaldo et al. 1988
- S. epidermidis (Winslow and Winslow 1908) Evans 1916
- S. equorum Schleifer et al. 1985
- S. equorum subsp. equorum Schleifer et al. 1985
- S. equorum subsp. linens Place et al. 2003
- S. felis Igimi et al. 1989
- S. fleurettii Vernozy-Rozand et al. 2000
- S. gallinarum Devriese et al. 1983
- S. haemolyticus Schleifer & Kloos 1975
- S. hominis Kloos & Schleifer 1975
- S. hominis subsp. hominis Kloos & Schleifer 1975
- S. hominis subsp. novobiosepticus Kloos et al. 1998
- S. hyicus (Sompolinsky 1953) Devriese et al. 1978
- S. intermedius Hájek 1976
- S. kloosii Schleifer et al. 1985
- S. lentus (Kloos et al. 1976) Schleifer et al. 1983
- S. lugdunensis Freney et al. 1988
- S. lutrae Foster et al. 1997
- S. muscae Hájek et al. 1992
- S. nepalensis Spergser et al. 2003
- S. pasteuri Chesneau et al. 1993
- S. pettenkoferi Trülzsch et al. 2007
- S. piscifermentans Tanasupawat et al. 1992
- S. pseudintermedius Devriese et al. 2005
- S. saccharolyticus (Foubert and Douglas 1948) Kilpper-Bälz and Schleifer 1984
- S. saprophyticus (Fairbrother 1940) Shaw et al. 1951
- S. saprophyticus subsp. bovis Hájek et al. 1996
- S. saprophyticus subsp. saprophyticus (Fairbrother 1940) Shaw et al. 1951
- S. schleiferi Freney et al. 1988
- S. schleiferi subsp. coagulans Igimi et al. 1990
- S. schleiferi subsp. schleiferi Freney et al. 1988
- S. sciuri Kloos et al. 1976
- S. sciuri subsp. carnaticus Kloos et al. 1997
- S. sciuri subsp. rodentium Kloos et al. 1997
- S. sciuri subsp. sciuri Kloos et al. 1976
- S. simiae Pantucek et al. 2005
- S. simulans Kloos and Schleifer 1975
- S. succinus Lambert et al. 1998
- S. succinus subsp. casei Place et al. 2003
- S. succinus subsp. succinus Lambert et al. 1998
- S. vitulinus corrig. Webster et al. 1994
- S. warneri Kloos and Schleifer 1975
- S. xylosus Schleifer and Kloos 1975
Literatur
- Frank Kipp, Alexander W. Friedrich, Karsten Becker, Christof von Eiff: Bedrohliche Zunahme Methicillin-resistenter Staphylococcus-aureus-Stämme. In: Deutsches Ärzteblatt. Nr. 101 (28–29), Köln 2004, S. A2045 - A2051, ISSN 0012-1207
- H. Linde, N. Lehn: Methicillin-resistenter Staphylococcus aureus (MRSA). In: Dtsch. med. Wochenschr. Nr. 130. 2005, S. 582–585.
- H. J. Sinell: Bedeutung von Staphylokokken-Enterotoxin in Lebensmitteln. In: Med. Klin. Nr. 71, 1976, S. 1165—1171.
Einzelnachweise
- ↑ Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/Wien 1965.
- ↑ John G. Holt, Noel R. Krieg, Peter H. A. Sneath, James T. Staley, Stanley T. Williams (Hrsg.): Bergey's Manual of Determinative Bacteriology. 9. Auflage. Williams & Wilkins, Baltimore u. a. O. 1994, ISBN 0-683-00603-7, S. 532, 535-536, 544-551.
- ↑ T. Kaneda: Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. In: Microbiol. Rev. 55(2); June 1991: S. 288-302 PMID 1886522 (freier Volltextzugang)
- ↑ Daunderer - Klinische Toxikologie - 105. Erg.-Lfg. 4/96
- ↑ Daunderer - Klinische Toxikologie - 105. Erg.-Lfg. 4/96
- ↑ George Y. Liu, Anthony Essex u. a.: Staphylococcus aureus golden pigment impairs neutrophil killing and promotes virulence through its antioxidant activity. In: Journal of Experimental Medicine. Bd. 202, 2005, PMID 16009720 , doi:10.1084/jem.20050846 , S. 209–215
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Enterobakterien
Die Enterobakterien oder Enterobacteriaceae (vorläufig die einzige Familie in der Ordnung Enterobacteriales) sind eine große Gruppe innerhalb der Domäne Bacteria. Nach dem phylogenetischen System gehören sie zum Phylum (Stamm) Proteobacteria und bilden dort eine eigene Familie.
Der Name Enterobakterien leitet sich vom griechischen Enteron (Darm) ab, weil viele von ihnen typische Darmbewohner sind. Aber auch viele freilebende, nicht darmbewohnende Bakterienarten gehören in diese Familie.
Aussehen/Stoffwechsel
Sie sind stäbchenförmig und gewöhnlich 1 bis 5 µm lang und besitzen einen Durchmesser von etwa 0,5 - 1,0 µm. Von ähnlichen Bakterien können sie durch das Fehlen von Oxidase unterschieden werden. Die meisten können sich mit Flagellen aktiv bewegen, es kommen jedoch auch Gattungen vor, die sich nicht aktiv bewegen können. Da die Zellwand aus wenigen Mureinschichten und einer zweiten, äußeren Membran aus Phospholipiden und Lipopolysacchariden besteht, sind die Enterobakterien gramnegativ.
Ihr Stoffwechsel ist fakultativ anaerob, daher können sie sowohl über Oxidation unter Anwesenheit von Sauerstoff Stoffe abbauen, als auch unter anaeroben Bedingungen (kein Sauerstoff) Gärung betreiben. Zwei wichtige anaerobe Stoffwechselwege, die zur Unterscheidung der einzelnen Gattungen genutzt werden, sind die 2,3-Butandiolgärung und die gemischte Säuregärung (mixed acids fermentation). Bei der gemischten Säuregärung treten als End- und Nebenprodukte vorwiegend Säuren, wie Essigsäure, Milchsäure und Bernsteinsäure (Succinat), aber kein Butandiol auf. Bei der 2,3-Butandiolgärung entstehen aus der Gärung von Glucose als End- und Nebenprodukte geringere Mengen von Säuren, aber vor allem in großen Mengen der Alkohol 2,3-Butandiol. Ein weiteres Merkmal der 2,3-Butandiolgärung ist das Zwischenprodukt Acetoin und die wesentlich höhere Gasproduktion (CO2). Man findet Butandiolgärung z. B. bei Enterobacter, Klebsiella, Erwinia und Serratia. Gemischte Säuregärung nutzen u. a. Gattungen wie Escherichia coli, Salmonella und Proteus.
Zur Bestimmung der einzelnen Gattungen wird eine Vielzahl von Diagnosetests genutzt. Zum Beispiel wird mit Hilfe des Voges-Proskauer-Tests das Zwischenprodukt Acetoin der 2,3-Butandiolgärung nachgewiesen.
Vorkommen
Viele Enterobakterien sind Teil der gesunden Darmflora von Menschen und Tieren; sie kommen jedoch auch überall in der Umwelt vor (Boden, Wasser). Einige sind Krankheitserreger bei Mensch und Tier. Sie kommen vielfach als nosokomiale Erreger vor („Krankenhauskeime“) und befallen Menschen mit schwachem Immunsystem.
Der wahrscheinlich wichtigste Vertreter der Enterobakterien ist Escherichia coli, einer der wichtigsten Modellorganismen der Genetik und Biochemie sowie der Mikrobiologie. Auffällig ist des Weiteren die Gattung Proteus, bei der man das sogenannte Schwärm-Phänomen beobachtet. Wenn sich wachsende Kolonien dieser Bakterien auf einer Agar-Platte ausbreiten, sieht man einen Bakterienrasen mit konzentrischen Ringen.
Gattungen
Zu den Enterobakterien gehören[1].:
- Arsenophonus Gherna et al. 1991
- Brenneria Hauben et al. 1999
- Buchnera Munson et al. 1991
- Budvicia Bouvet et al. 1985
- Buttiauxella Ferragut et al. 1982
- Cedecea Grimont et al. 1981
- Citrobacter Werkman and Gillen 1932
- Dickeya Samson et al. 2005
- Edwardsiella Ewing and McWhorter 1965
- Enterobacter Hormaeche and Edwards 1960
- Erwinia Winslow et al. 1920, z. B.: Erwinia amylovora
- Escherichia Castellani and Chalmers 1919, z. B.:Escherichia coli
- Ewingella Grimont et al. 1984
- Hafnia Møller 1954
- Klebsiella Trevisan 1885, z. B.:Klebsiella pneumoniae
- Kluyvera Farmer et al. 1981
- Leclercia Tamura et al. 1987
- Leminorella Hickman-Brenner et al. 1985
- Moellerella Hickman-Brenner et al. 1984
- Morganella Fulton 1943
- Obesumbacterium Shimwell 1963
- Pantoea Gavini et al. 1989 emend. Mergaert et al. 1993
- Pectobacterium Waldee 1945
- Photorhabdus Boemare et al. 1993
- Plesiomonas corrig. Habs and Schubert 1962, z. B.: Plesiomonas shigelloides
- Pragia Aldová et al. 1988
- Proteus Hauser 1885, z. B.: Proteus vulgaris, Proteus mirabilis
- Providencia Ewing 1962
- Rahnella Izard et al. 1981
- Raoultella Drancourt et al. 2001
- Saccharobacter Yaping et al. 1990
- Salmonella Lignieres 1900
- Samsonia Sutra et al. 2001
- Serratia Serratia Bizio 1823, z. B.: Serratia marcescens
- Shigella Castellani and Chalmers 1919
- Sodalis Dale and Maudlin 1999
- Tatumella Hollis et al. 1982
- Thorsellia Kämpfer et al. 2006
- Trabulsiella McWhorter et al. 1992
- Wigglesworthia Aksoy 1995
- Xenorhabdus Thomas and Poinar 1979
- Yersinia, van Loghem 1944, z. B.: Yersinia pestis, Auslöser der Lungen- und Beulenpest
- Yokenella Kosako et al. 1985
Einige Synonyme und Umstellungen
- Alle Arten von Levinea Young et al. 1971 wurden zu der Gattung Citrobacter Werkman and Gillen 1932 gestellt
- Verschiedene Erwinia-Arten wurden in die Gattungen Pantoea, Enterobacter, Pectobacterium und Brenneria aufgeteilt.
- Liquidobacterium ist ein Synonym für Proteus
Literatur
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock - Mikrobiologie, Spektrum Akademischer Verlag, Heidelberg, Berlin 2001, ISBN 3-8274-0566-1
Einzelnachweise
- ↑ Systematik und Umstellungen nach Euzéby: List of Prokaryotic Names with Standing in Nomenclature (LPSN) (Stand August 2007)
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Pseudomonas
Pseudomonas (Plural Pseudomonaden) ist eine Gattung stäbchenförmiger, mit polaren Geißeln sich aktiv bewegender, aerober, gramnegativer Bakterien. Sporen werden nicht gebildet. Das Genom der Art P. aeruginosa wurde vollständig sequenziert.[1] (s. h. auch: Liste sequenzierter Organismen)
Merkmale und Stoffwechsel
Die Größe variiert zwischen 0,5–1,0 × 1,5–5,0 µm. Sie können sich mit einer oder mehreren polaren Geißeln aktiv bewegen (sie sind motil). Sie reagieren im Voges-Proskauer-Test negativ, im Katalase-Test positiv. Bei den meisten Arten fällt der Oxidase-Test positiv aus, wie z.B. bei Pseudomonas fluorescens, diese Arten besitzen somit ein c-Typ-Cytochrom.
Pseudomonaden sind aerob, das heißt, sie brauchen in der Regel Sauerstoff für ihren Energiestoffwechsel, um zu wachsen. Sie nutzen also einen oxidativen Energiestoffwechsel mit Sauerstoff als Elektronenakzeptor. Zucker werden dabei über den Entner-Doudoroff-Weg zur Energiegewinnung abgebaut. Nitrat kann bei den meisten Arten als alternativer Elektronenakzeptor statt Sauerstoff bei der Atmung dienen (Nitratatmung). In diesem Fall wird Nitrat (NO3−) zu elementarem, molekularem Stickstoff (N2) reduziert (Denitrifikation). Da für die Nitratatmung kein Sauerstoff nötig ist, sind einige Arten auch in der Lage, unter Ausschluss frei gelösten Sauerstoffs (anoxisch) zu wachsen, doch dies ist eher selten der Fall. Als Vertreter der nitratreduzierenden Bakterien werden die Arten Pseudomonas aeruginosa, Pseudomonas stutzeri und Pseudomonas denitrificans bei der Abfallbehandlung zur Nitratelimination eingesetzt. Eine der wenigen Arten, die nicht zur Nitratatmung fähig sind, ist Pseudomonas fluorescens.
Fermentation wird von dieser Gattung nicht als Energiestoffwechsel genutzt, alle Arten sind sogenannte Nonfermenter (Nichtfermentierer).
Mehrere Pseudomonas-Arten produzieren bei Eisenmangel Siderophore; mindestens 50 verschiedene Pyoverdine wurden gefunden, außerdem Ferrioxamine, die sonst nur in Actinobakterien vorkommen.[2]
Ökologie
Pseudomonaden sind ubiquitär, also allgegenwärtig in der Umwelt („Pfützenkeim“). Man findet sie im Boden, Wasser sowie in oder auf Pflanzen und Tieren. Pseudomonaden leben oft saprotroph, also von abgestorbenem organischen Material. Man findet sie auch häufig in der Rhizosphäre, diese von den Pflanzen beeinflusste Umgebung stellt ein gutes Habitat für Pseudomonaden dar, sie sind gut an die Rhizosphäre angepasst.[3] So bewegen sie sich unter anderem aktiv, sind chemotaxisch und resistent gegen spezielle Abwehrstoffe der Pflanzen. Obwohl einige pflanzenpathogen sind, tragen viele Arten auch zum Schutz der Pflanzen bei, indem sie innerhalb der Rhizosphäre andere Mikroorganismen verdrängen. Des Weiteren sind einige Arten wie Pseudomonas putida mit arbuskulären Mykorrhizapilzen assoziiert und fördern somit sogar das Wachstum der Pflanzen.[4] Man spricht von plant growth promoting rhizobacteria (PGPR).
Pathogenität
Die Pseudomonaden sind physiologisch hoch flexibel und können auch als opportunistische Krankheitserreger bei bereits geschwächten Pflanzen und Tieren auftreten. Von vielen Pseudomonas-Arten existieren pflanzenpathogene Stämme, so genannte Pathovare (Phytopathogene). Die Art Pseudomonas marginalis verursacht, meist an Sprossachsen, die Weichfäule. Pseudomonas syringae subsp. savastanoi pv. oleae verursacht die Tuberkelkrankheit beim Olivenbaum. Bei Tieren kann u. a. die Fleckenseuche der Süsswasserfische von Pseudomonas verursacht werden. Arten wie Pseudomonas aeruginosa können für Menschen mit geschwächtem Immunsystem gefährlich sein.
Die Virulenzgene sind meistens mobil (Plasmide) und können leicht von einer Pseudomonas-Art auf eine andere, aber auch auf entfernter verwandte Bakterien übertragen werden. So besitzen die Pseudomonaden oft ein sogenanntes R-Plasmid, welches der Übertragung der Resistenzgene dient.
Das hochgefährliche Nervengift Tetrodotoxin (TTX) wird von einigen Pseudomonas-Arten produziert. Auch anhydro-TTX, eine im molekularen Aufbau leicht abweichende Variante, wurde bei dieser Gattung nachgewiesen. Pseudomonas und auch verschiedene Vibrionen werden für die starke Giftigkeit verschiedener Kugelfische verantwortlich gemacht.[5] Der Fisch nimmt die Bakterien vermutlich durch die Nahrung (z. B. verschiedene Krebstiere, Würmer und Rotalgen) auf. Pseudomonas wurde bei dem Kugelfisch Takifugu poecilonotus (Synonym: Fugu poecilonotus) nachgewiesen.[6] Man geht hierbei von einer Symbiose zwischen dem Kugelfisch und den Bakterien aus. Der Kugelfisch setzt das Gift für die Verteidigung bzw. Abschreckung gegen Räuber ein und liefert den Bakterien wiederum ein geeignetes Habitat. Die Fähigkeit der Bakterien, insbesondere der Vibrionen, Tetrodotoxin zu bilden, wurde allerdings wieder in Frage gestellt.[7][8]
Klinische Bedeutung
Die Gattung ist klinisch besonders wichtig, weil die Mehrheit ihrer Mitglieder Resistenzen gegen Antibiotika aufweist. Außerdem sind sie fähig, bei höherer Zelldichte Biofilme (Schleime) zu bilden, die sie gegen Fresszellen und Antibiotika schützen. Während Bakterien der Gattung Pseudomonas bei Menschen mit intaktem Immunsystem selten Krankheiten verursachen, können sie bei Patienten, deren Immunsystem bereits geschwächt ist (beispielsweise in Krankenhäusern, sogenannte Hospitalismuskeime), die Infektion von Wunden, Atem- und Harnwegen, Lungenentzündung sowie Sepsis und Herzerkrankungen verursachen. Wundinfektionen durch P. aeruginosa zeichnen sich durch ihre blau-grüne Färbung und ihren süßlich-aromatischen Geruch aus. Besonders gefährdet sind Patienten mit der Erbkrankheit Cystische Fibrose (Mukoviszidose), bei denen Lungenentzündungen durch Pseudomonas die häufigste Todesursache ist.
Zur Therapie eignen sich Acylaminopenicilline wie Azlocillin und Piperacillin, Cephalosporine ab der dritten Generation (insbesondere Ceftazidim und Cefepim; Ceftriaxon hingegen ist nicht wirksam), neuere Fluorchinolone, Aminoglykoside sowie Carbapeneme.
Klinische Studien zu Pseudomonas-Impfungen werden seit einiger Zeit durchgeführt, etwa vom österreichischen Biotech-Unternehmen Intercell, das seinen Impfstoff bereits in Phase III testet.[9]
Literatur
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock - Mikrobiologie. 11. Auflage. Pearson Studium, München 2006, ISBN 3-8274-0566-1
- George M. Garrity: Bergey's manual of systematic bacteriology. 2. Auflage. Springer, New York, 2005, Volume 2: The Proteobacteria, Part B: The Gammaproteobacteria Genus Pseudomonas.
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.) The Prokaryotes, A Handbook of the Biology of Bacteria. 7 Bände, 3. Auflage, Springer-Verlag, New York u. a. O., 2006, ISBN 0-387-30740-0. Vol. 6: Proteobacteria: Gamma Subclass ISBN 0-387-30746-X
Einzelnachweise
- ↑ Pseudomonas Genome Project
- ↑ Essén SA, Johnsson A, Bylund D, Pedersen K, Lundström US: Siderophore production by Pseudomonas stutzeri under aerobic and anaerobic conditions. In: Appl. Environ. Microbiol.. 73, Nr. 18, September 2007, S. 5857–64. doi:10.1128/AEM.00072-07 . PMID 17675442 . Volltext bei PMC: 2074896 .
- ↑ Lugtenberg, B. J. J. und G. V. Bloemberg. 2004. Life in the rhizosphere. In: J. L. Ramos (Ed.) Pseudomonas. Kluwer Academic/Plenum Publishers. New York, NY. 1:S. 403–430.
- ↑ Veronica Artursson, Roger D. Finlay und Janet K. Jansson: Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth In: Environmental Microbiology (2006) 8(1), 1–10, PMID 16343316
- ↑ A.C. Scoging: Marine biotoxins In: Journal of Applied Microbiology Symposium Supplement 1998, 84, 418-508 Blackwell-Synergy
- ↑ Yotsu, M., T. Tamazaki, Y. Meguro, A. Endo, M. Murata, H. Naoki, and T. Yasumoto: Production of tetrodotoxin and its derivatives by Pseudomonas sp. isolated from the skin of a pufferfish. In: Toxicon 25 (1987):225–228. PMID 3576639
- ↑ Kendo Matsumura: Reexamination of Tetrodotoxin Production by Bacteria In: Applied and Environmental Microbiology, Sept. 1995, p. 3468–3470 AEM Online
- ↑ Kim, D.S., Kim, C.H.: No ability to produce tetrodotoxin in bacteria — authors reply. In: Applied and Environmental Microbiology, May 2001, p. 2393–2394 AEM Online
- ↑ http://www.xxx
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Proteinbiosynthese - Proteinsynthese
(Weitergeleitet von Proteinsynthese)
Die Proteinbiosynthese oder Genexpression, früher auch Eiweißsynthese genannt, ist die Herstellung eines Proteins oder Polypeptids in Lebewesen. Sowohl Proteine als auch Polypeptide und Oligopeptide sind Ketten aus Aminosäuren, die sich in ihrer Länge und ihrer Abfolge unterscheiden. Sie werden aufgrund der in der Desoxyribonukleinsäure (DNA) gegebenen Erbinformation an den Ribosomen lebender Zellen gebildet.
Unterprozesse der Proteinbiosynthese
1. Transkription
Bei diesem ersten Schritt der Proteinbiosynthese wird ein Gen aus der DNA abgelesen und in ein mRNA (Messenger-RNA) -Molekül transkribiert. Bei diesem Vorgang werden die Nukleinbasen der DNA (Adenin – Thymin, Guanin – Cytosin) in die Nukleinbasen der RNA (Adenin – Uracil, Guanin – Cytosin) umgeschrieben. Anstelle des Thymins kommt Uracil und anstelle der Desoxyribose kommt Ribose in der RNA vor. Wichtig ist dieser Schritt deshalb, da die DNA den Zellkern nicht verlassen kann.
Die Transkription des Gens wird durch das Enzym RNA-Polymerase (und mehrere andere Proteine) katalysiert, das als Substrat DNA und die Ribonukleosidtriphosphate ATP, UTP, CTP und GTP benötigt. Daraus wird komplementär zu einem DNA-Strang eine fortlaufende RNA-Kette (mRNA) unter Abspaltung jeweils zweier Phosphatreste der Triphosphate hergestellt. Codogen (DNA) → Codon (mRNA)
In Eukaryoten existieren unterschiedliche Typen der RNA-Polymerase, da auch Gene vorhanden sind, die nicht für mRNA, sondern für rRNAs und tRNAs codieren.
Bei Eukaryoten findet die Transkription im Zellkern statt, sodass die mRNA in das Cytosol gebracht werden muss, da dort mit ihr die Translation durchgeführt wird. Bei Prokaryoten findet die Transkription im Zellplasma, auch Cytoplasma genannt, statt.
2. Translation
Unter Translation versteht man die Übersetzung der Basensequenz der mRNA in die Aminosäuresequenz des Proteins, die an den Ribosomen geschieht. In der mRNA bilden drei aufeinander folgende Basen ein Codon (auch Basentriplett), welches für eine Aminosäure codiert (siehe genetischer Code). Die Aminosäuren werden entsprechend der Abfolge der Codons sequentiell translatiert.
Da es keine strukturelle Verwandtschaft zwischen Codon und der dazugehörigen Aminosäure gibt, wird ein Zwischenstück benötigt, das einerseits die Aminosäure bindet und andererseits das zugehörige Codon auf der mRNA erkennt. Für diesen Vorgang sind als Aminosäuren-"Transporter" die tRNAs (Transfer-RNAs) notwendig. Sie besitzen zwei exponierte Bindungsstellen: Das Anticodon und die Aminosäurebindungsstelle. Die Aminosäurebindungsstellen der tRNAs werden durch die Aminoacyl-tRNA-Synthetasen spezifisch mit der passenden Aminosäure beladen. Die tRNA erkennt mit dem Anticodon das komplementäre Codon auf der mRNA und bindet spezifisch daran.
Zur Ausbildung einer Peptidbindung zwischen zwei Aminosäuren müssen sie in räumliche Nähe zueinander gebracht werden. Da ein oder mehrere Enzyme alleine dazu nicht in der Lage sind, wird die Oberfläche einer großen supramolekularen Struktur benötigt. Diese Aufgabe erfüllen die Ribosomen. (Es gibt eine große und eine kleine Untereinheit bei Ribosomen; die große Untereinheit gliedert sich in die A-Bindungsstelle und die P-Bindungsstelle). Der Translationsprozess als solcher lässt sich in drei Phasen unterteilen: die Initialphase, Elongationsphase und schließlich Termination. Erreicht eine zuvor synthetisierte mRNA ein Ribosom, so wandert die kleine Untereinheit des Ribosoms solange an der mRNA entlang, bis sie auf das Startcodon AUG stößt. Die dazu passende Methionin-tRNA mit dem Anticodon UAC heftet sich an das Codon (Initiationskomplex). Unter Spaltung von GTP lagert sich nun auch die große Untereinheit des Ribosoms an und die Elongation beginnt. Die Methionin-tRNA befindet sich bei der Initiationsphase auf der P-Bindungsstelle, sodass sich in der A-Bindungsstelle die nächste tRNA anlagern kann. Eine Peptidyltransferase verknüpft das Methionin der ersten tRNA mit der Aminosäure der nachfolgenden tRNA; diese Bildung eines Dipeptids findet in der A-Bindungsstelle statt. Schließlich wandern die Ribosomeneinheiten um ein Basentriplett weiter. Die tRNA mit dem Dipeptid befindet sich nun auf der P-Bindungsstelle, von welcher es die allererste, nun unbeladene tRNA verdrängt hat, und an die freie A-Bindungsstelle kann sich wieder die nächste tRNA anlagern, deren Anticodon komplementär zum Basentriplett des mRNA-Stranges passt.
Bei Erreichen eines Stoppcodons, welches für keine Aminosäure codiert, wird die Translation durch die Bindung eines sogenannten Freisetzungsfaktors abgebrochen (Termination).
Co- und Posttranslationale Modifikationen
Einige Proteine werden nach (posttranslational) oder während (cotranslational) der Translation durch spezielle Enzyme spezifisch modifiziert. Das können Abspaltungen von Propeptiden oder Hydroxylierungen von Aminosäuren (Prolin zu 4-Hydroxyprolin durch die Prolyl-4-Hydroxylase, Lysin zu Hydroxylysin durch die Lysylhydroxylase) oder Decarboxylierungen oder Oxidationen (z.B. kovalente Quervernetzungen mittels Lysinresten durch die Lysyloxidase) oder Glykosylierungen oder formgebende Prozesse durch Chaperone sein. Manche dieser Modifikationen verlaufen quasi am Ort der Translation, andere dürfen etwa erst im Extrazellularraum stattfinden. Das Kollagenmolekül durchläuft besonders viele posttranslationale Modifikationsschritte
Proteintargeting und Proteintransport
Da viele Proteine als Zielort (engl. target) nicht das Zytosol, sondern den Extrazellularraum, die Zellmembran, die Organellen wie Chloroplasten, Mitochondrien, Peroxisomen, Zellkern oder endoplasmatisches Retikulum haben, hat die Zelle verschiedene Mechanismen, die Proteine dorthin zu verbringen. Diese Proteine enthalten meist eine N- oder auch C-terminale Signalsequenz, die je nach Targetmechanismus sehr unterschiedlich aufgebaut sein kann. In einigen Fällen gibt es keine terminale Signalsequenz, sondern interne Signale der Peptidkette, die über den Zielort des Proteins bestimmt.
- Proteine, deren Ziel das Endoplasmatische Retikulum (ER) ist, tragen eine spezifische N-terminale Sequenz, die von einem Protein-RNA-Komplex, dem Signal Recognition Particle (SRP), erkannt wird. Der SRP-Peptid-Ribosom-Komplex wird dann zum Endoplasmatischen Retikulum rekrutiert, wo er erkannt und gebunden wird. Die Translation wird durch die Membran fortgesetzt. Durch die anheftenden Ribosomen entsteht der Eindruck eines „rauen ERs“. Siehe Cotranslationaler Proteintransport. Im Endoplasmatischen Retikulum findet die Qualitätskontrolle des neu synthetisierten Proteins statt.
- Proteine, die in die Chloroplasten verbracht werden müssen, besitzen eine N-terminale Signalsequenz, die gewöhnlich früh phosphoryliert wird. Die Proteine Hsp70, 14-3-3 und Toc64 können weiterhin durch Interaktion mit dem Protein-Vorläufer eine Rolle bei der Erkennung und Weiterleitung spielen. Der Protein-Precursor-Komplex wird nach der Ankunft auf der Oberfläche des Chloroplasten von Rezeptorstrukturen des Translokonapparates der äußeren Chloroplastenmebran (Translocon Of Outer Chloroplast Membrane, TOC) erkannt. Unter GTP-Hydrolyse wird das Protein dann in den Intermembranraum importiert oder direkt durch den Translokonapparat (TIC) der inneren Chloroplastenmembran in das Stroma importiert. Für den Import in die Membran oder das Lumen der Thylakoide werden mindestens 4 Wege genutzt, die als Sec-abhängig, SRP-abhängig, delta-pH/Tat-abhängig oder spontan bezeichnet werden.
- Für das Mitochondrium wurden für Hefe- und Tierzellen bislang drei verschiedene Import-Wege beschrieben:
- Der Präsequenz-Importweg, dessen Proteine eine N-terminale amphiphile alpha-Helix tragen. Diese Proteine sind meist für die Matrix, die innere Membran oder den Intermembranraum bestimmt.
- Der Carrier-Protein-Importweg für Proteine der inneren Membran, welche verschiedene interne Signale tragen.
- Der Importweg der Proteine der äußeren Hüllmembran, der zur Integration von Proteinen mit beta-Fass-Motiv genutzt wird. Auch hier liegen sequenzinterne Signale vor.
Alle drei Importwege beginnen am mitochondrialen Translokonapparat in der äußeren Membran (TOM), welcher verschiedene Rezeptoren besitzt. So erkennen die Rezeptoren Tom20 und Tom22 das N-terminale Signal und leiten das Vorläufer-Protein an die Pore Tom40 weiter. Der Rezeptor Tom70 erkennt die internen Signale der Proteine, die für die äußere Membran bestimmt sind.
Nach dem Import in den Intermembranraum trennen sich die Wege: Die Proteine mit beta-Fass-Motiv, welche für die äußere Membran bestimmt sind, werden durch den SAM-Komplex (Sorting and assembly machinery) in die Membran integriert. Die Proteine der anderen beiden Importwege werden zu verschiedenen TIM-Komplexen dirigiert: Proteine mit Präsequenz werden von dem TIM23-Komplex erkannt, Proteine für die innere Membran dagegen vom TIM22-Komplex.
Die Präsequenz wird durch das Enzym MPP (mitochondrial processing peptidase) entfernt.
Neben den oben beschriebenen Signalsequenzen ermöglicht eine Glykosylierung ein Targeting für den Einbau in die Zellmembran bzw. für die Exozytose. Beide Wege führen meist über Golgi-Vesikel.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
Ciprofloxacin
Ciprofloxacin ist ein Antibiotikum mit breitem Wirkspektrum aus der Gruppe der Fluorchinolone. Die Substanz wurde 1981 von der Firma Bayer entwickelt und 1983 patentiert. Antibiotika dieser Gruppe hemmen die Gyrase von Bakterien und damit ihre DNA-Replikation und ihre Zellteilung. Sie wirken dadurch bakterizid, und zwar vor allem gegen gramnegative Keime.
Spektrum
Ciprofloxacin eignet sich gut gegen alle bakteriellen Erreger einer infektiösen Darmerkrankung. Außerdem ist es wirksam gegen den Problemkeim Pseudomonas aeruginosa. Bei Harnwegsinfektionen, die auch von Darmbakterien oder unter Umständen von Pseudomonaden ausgelöst werden, gilt es als Reserveantibiotikum. Weitere Anwendungsgebiete sind Infektionen der Gallenwege, Atemwege, der Bauchhöhle (Peritonitis) und viele andere Infektionskrankheiten bei Nachweis eines entsprechend empfindlichen Erregers. Ciprofloxacin ist auch zur Behandlung des Milzbrands zugelassen. Ciprofloxacin kann wie andere moderne Chinolone neben Makroliden und Rifampicin zur Behandlung der Pneumonie durch Legionellen eingesetzt werden.
Nebenwirkungen
Häufigste Nebenwirkungen (jedoch unter 10 %) sind Übelkeit, Durchfall und Hautausschläge. Fluorchinolone haben im Tierversuch bei jungen Hunden Störungen des Knorpelwachstums verursacht, deshalb sollen sie nicht in der Schwangerschaft, Stillzeit und nicht bei Kindern eingesetzt werden. Davon abweichend ist Ciprofloxacin aufgrund seiner Wirksamkeit gegen Pseudomonas jedoch zur Behandlung von Kindern und Jugendlichen (5–17 Jahre) mit akuten, durch P. aeruginosa verursachten Infektionsschüben einer zystischen Fibrose zugelassen. Weitere Nebenwirkungen sind Neurotoxizität, Lebertoxizität und allergische Reaktionen, auch das Red man syndrome wurde beschrieben. Des Weiteren gibt es mehrere Studien, die den Nachweis erbrachten, dass Ciprofloxacin die Krampfschwelle senken kann: Ein Einsatz bei Patienten mit Anfallsleiden sollte daher nur unter strenger Indikationsstellung erfolgen.[3][4]
Es können Schmerzen, Schwellungen, Risse und Entzündungen der Sehnen aufkommen, einschließlich der Rückseite des Knöchels (auch Schulter-, Hand-, oder andere Sehnensysteme). Dies gilt für Menschen aller Altersgruppen, die Fluorchinolon-Antibiotika einschließlich Ciprofloxacin einnehmen. Die häufigste Bereich der Schmerzen und Schwellungen ist die Achillessehne. Sehnenrupturen können während oder auch noch mehrere Monate nach der Einnahme von CIPRO erfolgen. Das Risiko von Sehnen-Schäden ist bei Patienten über 60 J. höher, vor allem bei Einnahme von Steroiden (Kortikosteroide) oder nach Nieren-, Herz- oder Lungentransplantation. Sehnenschwellungen (Tendinitis) und -risse (Bruch) wurden auch bei Patienten, die Fluorchinolone einnahmen, aber keine der übrigen v.g. Risikofaktoren aufwiesen, festgestellt. Nach einer Feststellung besagter Folgen sollen Bewegungen vermieden werden.[5] Erklärt wird die Nebenwirkung mit einer erhöhten Wirksamkeit von Matrix-Metalloproteinasen, die die Festigkeit der Sehnen herabsetzen können.[6]
Wechselwirkungen
Patienten mit Herzrhythmusstörungen oder Krampfanfällen in der Vorgeschichte sollten coffeinhaltige Lebens- (z.B.: Kaffee, Cola, schwarzer Tee, grüner Tee) und Arzneimittel (häufig Schmerzmittelkombination, Erkältungsmittel) vermeiden. Der Abbau von Coffein wird durch Cytochrom P450 (Isoenzym 1A2) katalysiert. Einige Gyrasehemmer greifen in den Coffeinmetabolismus ein und blockieren das Cytochrom P450, wodurch der Hauptabbauweg der N-Demethylierung zum Paraxanthin betroffen ist. Dadurch kommt es zu einer Wirkverstärkung des Coffeins. Eine vergleichbare Wechselwirkung tritt mit dem strukturähnlichen Methylxantin Theophyllin auf.
Da Ciprofloxacin zu den Fluorchinolonen gehört, könnte es wie andere Antibiotika dieser Gruppe die Wirksamkeit hormoneller Kontrazeptiva herabsetzen. Für den speziellen Fall von Ciprofloxacin hat sich ein solcher Verdacht jedoch bisher nicht bestätigt. In der aktuellen Packungsbeilage von Ciprofloxacin (Stand 2006) wird eine Wechselwirkung zwischen diesem Antibiotikum und hormonellen Kontrazeptiva nicht erwähnt. Mindestens zwei klinische Studien belegen, dass Ciprofloxacin die Wirksamkeit der Antibabypille nicht beeinträchtigt.[7][8] Die Nicht-Beeinträchtigung hormoneller Kontrazeptiva war auch der Grund, dass Ciprofloxacin statt Rifampicin an 4253 Student(inn)en der Universität Oxford ausgegeben wurde, um die Ausbreitung einer Meningokokken-Meningitis zu verhindern.[9]
Anwendung
Die Dosierung und Anwendung von Ciprofloxacin ist abhängig von der zu behandelnden Erkrankung / Infektion. Allgemein wird Ciprofloxacin zweimal täglich verabreicht, vorzugsweise in peroraler Form (p.o.) als Tablette. Zur Gonorrhoe (Tripper) - Therapie ist schon eine einmalige Gabe von 500 mg Ciprofloxacin p.o. in Tablettenform ausreichend. Es sind auch Zubereitungen für die intravenöse Gabe sowie die örtliche Anwendung als Ohren- und Augentropfen erhältlich.
Handelsnamen
Monopräparate
Agyr (A), Ciloxan (D, A, CH), Ciprobay (D), Ciproxin (A, CH), InfectoCipro (D), Keciflox (D), Otanol (A), Panotile Cipro (D), Quinox (T) zahlreiche Generika (D, A, CH)
Kombinationspräparate
Ciproxin HC (CH) [10][11][12]
Weiterführende Literatur
- P. C. Scholten, R. M. Droppert u.a.: No interaction between ciprofloxacin and an oral contraceptive. In: Antimicrobial agents and chemotherapy. Band 42, Nummer 12, Dezember 1998, S. 3266–3268, ISSN 0066-4804 . PMID 9835524 . PMC 106032 .
- R. Davis, A. Markham, J. A. Balfour: Ciprofloxacin. An updated review of its pharmacology, therapeutic efficacy and tolerability. In: Drugs. Band 51, Nummer 6, Juni 1996, S. 1019–1074, ISSN 0012-6667 . PMID 8736621 . (Review).
Einzelnachweise
- ↑ a b c Datenblatt Ciprofloxacin BioChemika, ≥98.0% (HPLC) bei Sigma-Aldrich, abgerufen am 20. Juli 2008.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 386−387, ISBN 978-0-911910-00-1.
- ↑ J. M. Kushner, H. J. Peckman, C. R. Snyder: Seizures associated with fluoroquinolones. In: Ann Pharmacother. Band 35, 2001, S. 1194–1198.
- ↑ T. O. Grøndahl, I. A. Langmoen: Epileptogenic effect of antibiotic drugs. In: J Neurosurg. Band 78, 1993, S. 938–943.
- ↑ CIPRO Medication Guide - Reference ID: 2910764; BAYER Health Care Pharmaceuticals Inc, Wayne, NJ 07470 3/2011
- ↑ H. Vyas, G. Krishnaswamy: Quinolone-associated rupture of the Achilles' tendon. In: New England Journal of Medicine 2007. Artikel 357 (20): 2067.
- ↑ F. Maggiolo, G. Puricelli, M. Dottorini, S. Caprioli, W. Bianchi, F. Suter: The effect of ciprofloxacin on oral contraceptive steroid treatments, Drugs under Experimental and Clinical Research 17 (1991) 451-454.
- ↑ P. C. Scholten PC, Droppert RM, Zwinkels MGJ, Moesker HL, Nauta JJP, Hoepelman IM: No Interaction between Ciprofloxacin and an Oral Contraceptive. In: Antimicrobial Agents and Chemotherapy 42(12), 1998: 3266-3268.
- ↑ P. Burke, S. R. Burne: [www..xxx] In: BMJ. Band 320, Nummer 7236, März 2000, S. 679, ISSN 0959-8138 . PMID 10710576 . PMC 27310 .
- ↑ Rote Liste online, Stand: September 2009.
- ↑ AM-Komp. d. Schweiz, Stand: September 2009.
- ↑ AGES-PharmMed, Stand: September 2009.
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Harnwegsinfekt
Unter einem Harnwegsinfekt (HWI) versteht man eine durch Krankheitserreger verursachte Infektionskrankheit der ableitenden Harnwege. Die Infektion kann sich dabei bis in die Nieren und Blutbahn ausbreiten und infolgedessen zu bedrohlichen Krankheitsbildern führen. Harnwegsinfekte können sehr erfolgreich mit Antibiotika behandelt werden. Dabei kommen je nach dem Risikopotential des Patienten verschiedene Medikamente zur Anwendung. In unkomplizierten Fällen kommt es oft ohne Medikamentengabe zur Ausheilung der Erkrankung. Nichtmedikamentöse Maßnahmen können diese fördern.
Verbreitung
Die Anzahl der Neuerkrankungen in einem Jahr (Inzidenz) liegt bei Frauen im jüngeren Alter bei rund 5 %. Sie steigt im Alter auf rund 20 % an. Während bei jüngeren Männern Harnwegsinfekte eher selten sind, gleicht sich ihr Risiko bei zunehmendem Lebensalter dem der Frauen an.[1] Insgesamt gibt es drei Häufigkeitsgipfel für Harnwegsinfekte in der Bevölkerung. Ein erstes gehäuftes Auftreten findet sich bei Säuglingen und Kleinkindern, da diese öfter noch unbehandelte Fehlbildungen der Harnwege aufweisen. Ebenso sind in dieser Altersgruppe Schmierinfektionen häufiger. Der zweite Häufigkeitsgipfel betrifft erwachsene Frauen. Er wird auf die erhöhte Rate von Infekten bei sexueller Aktivität und die erhöhte Anfälligkeit bei Schwangerschaften zurückgeführt. Ältere Menschen beider Geschlechter sind das dritte Kollektiv mit erhöhter Häufigkeit der Erkrankung. Gründe hierfür sind Einengungen der Harnwege durch altersbedingte Degenerationen wie etwa eine Prostatahyperplasie oder ein Vorfall der Gebärmutter.[2]
Unter den im Krankenhaus erworbenen (nosokomialen) Infektionen zählen Harnwegsinfekte zu den häufigsten. Eine deutsche Studie aus den 1990er-Jahren veranschlagte den Anteil der Harnwegsinfekte an den nosokomialen Infektionen auf über 40 %.[3]
Krankheitsentstehung
Ein Harnwegsinfekt kommt in 95–98 % der Fälle über den Aufstieg der Erreger über die Harnröhre zustande. In den übrigen Fällen erfolgt die Infektion des Urogenitaltrakts über den Blutweg.[1][2] Die Erreger (in der Regel Bakterien) entstammen in den meisten Fällen der körpereigenen Darmflora, gelangen zur äußeren Harnröhrenöffnung und wandern die Harnröhre hinauf in die Harnblase, wo sie zu einer Blasenentzündung (Zystitis) führen. Bei weiterem Aufstieg kann es zu einer Nierenbeckenentzündung, einschließlich der Beteiligung des Nierengewebes selbst (Pyelonephritis), und schließlich zu einer Blutvergiftung (Urosepsis) kommen.[2][4]
Die Erreger müssen hierzu die körpereigenen Abwehrmechanismen überwinden. Diese bestehen aus dem Flüssigkeitsstrom in den ableitenden Harnwegen, dem Urothel, das einer Anhaftung von Bakterien entgegenwirkt, sowie aus IgA-Antikörpern, welche auf der Oberfläche des Urothels vorkommen. Dadurch wird die Blase beim Gesunden keimfrei gehalten. Der Urin selbst wirkt nur gegen wenige Arten antibakteriell und kann sogar das Wachstum vieler Formen von Erregern fördern. Faktoren, die den Keimen beim Aufstieg helfen, sind die Bildung einer Bakterien-Kapsel, die Produktion von Hämolysinen zur Auflösung von roten Blutzellen und die Ausbildung von fadenförmigen Zellorganellen, die der Anhaftung von Bakterien an das Oberflächengewebe der Harnwege dienen, sogenannten Pili.[2][4] Die Rezeptordichte für diese Pili sind im Eingang der Vagina, der Harnblase, des Harnleiters und des Nierenbeckenkelchsystems besonders hoch.[5]
Neben diesen Eigenschaften der Erreger fördern noch zahlreiche andere mögliche Faktoren des Wirts die Ausbildung eines Harnwegsinfekts. Instrumentelle Eingriffe wie zum Beispiel eine Blasenspiegelung oder ein Blasenkatheter bilden eine mögliche Eintrittspforte. Fehlbildungen der Harnwege, Funktionsstörungen der Blase oder auch eine Verminderung des Harnflusses beeinträchtigen das Ausspülen von Erregern und erleichtern so ihren Aufstieg. Ebenso ist sexuelle Aktivität ein Risikofaktor, da sie die Verschleppung von Keimen begünstigt. Diabetes mellitus trägt ebenso zu einer Harnwegsinfektion bei, da er die Funktionsfähigkeit des Immunsystems vermindert und die gegebenenfalls im Urin ausgeschiedene Glukose als Nährstoff für die Bakterien dient.[2] Weitere Risikofaktoren für Frauen sind der Gebrauch von Spermiziden oder Pessaren zur Verhütung. Ebenso kann eine vorhergehende Antibiotikatherapie durch das Abtöten der physiologischen Scheidenflora die Ansiedlung pathogener Keime begünstigen. Eine Harnwegsinfektion in der Vorgeschichte stellt – unabhängig vom Geschlecht – einen bedeutenden Risikofaktor dar, da Rezidive häufig sind.[6] Auch die vergleichsweise kurze Harnröhre bei Frauen wird als begünstigender Faktor für den Aufstieg von Erregern benannt. In aktuellen Publikationen wird aber die individuelle Infektanfälligkeit durch Abnormalitäten des Immunsystems stärker gewichtet als diese anatomische Tatsache.[5] So werden heute eine niedrige Ausscheidung des Proteins Uromodulin bei Kindern und Frauen, sowie gewisse Isotypen des T-Zell-Rezeptors mit erhöhter Häufigkeit von Harnwegsinfekten in Verbindung gebracht.[7]
Einteilung
Die Unterteilung erfolgt nach den beteiligten Organen in einen unteren oder oberen Harnwegsinfekt oder entsprechend der potentiellen Schwere des Verlaufs in einen komplizierten oder unkomplizierten Infekt.
Der untere Harnwegsinfekt betrifft nur die Harnröhre und Harnblase und wird vom oberen Harnwegsinfekt, bei dem die Nieren oder Harnleiter mitbeteiligt sind, abgegrenzt. Der obere entsteht meist aus einem unteren Harnwegsinfekt.[1]
Im Weiteren wird zwischen einem komplizierten und unkomplizierten Infekt unterteilt. Als kompliziert gelten Harnwegsinfekte bei Patienten, bei denen
- die Entstehung begünstigt wird, beispielsweise durch eingeschränkte Abwehrkräfte bei Immunsuppression oder Diabetes mellitus,
- normalerweise keine Harnwegsinfekte auftreten (Männer oder Kinder),
- Folgeschäden wahrscheinlich beziehungsweise besonders gefährlich sind (Schwangere, ältere Patienten),
- ein instrumenteller Eingriff an den ableitenden Harnwegen vorgenommen wurde (Harnblasenkatheter, Zystoskopie, Operation unabhängig davon, wie lange die Operation zurückliegt),
- eine anatomische oder neurologische Störungen der Blasenfunktion oder
- eine Fehlbildung (etwa Zystennieren) oder eine Niereninsuffizienz vorliegt.[6]
Von einem wiederkehrenden Harnwegsinfekt (Rezidiv) spricht man, wenn binnen sechs Monaten die Erkrankung zweimal oder während eines Jahres dreimal auftritt.[7]
Ein besonders schwerer, potentiell lebensgefährlicher Verlauf, bei dem die Bakterien in die Blutbahn gelangen, wird als Urosepsis bezeichnet.
Erregerspektrum
Man unterscheidet hierbei zwischen im Krankenhaus oder Pflegeeinrichtungen erworbenen sogenannten nosokomialen Harnwegsinfekten und in der Normalbevölkerung erworbenen sogenannten ambulant erworbenen Infekten.[4]
Außerhalb von Gesundheitseinrichtungen ist mit 70 % Escherichia coli, ein gramnegatives Stäbchenbakterium aus der Darmflora, führend. Des Weiteren treten auch andere Enterobakterien wie Klebsiellen oder Proteusarten auf. Auch Staphylokokken oder Enterokokken sind nicht ungewöhnlich. Selten können auch schwer nachzuweisende Keime wie Ureaplasma urealyticum oder Mycoplasma hominis vorkommen. Außerdem kann Chlamydia trachomatis, das vor allem sexuell übertragen wird, eine Harnwegsinfektion auslösen.[4] Ein weiterer sexuell übertragener Keim ist Neisseria gonorrhoeae, der Erreger der Gonorrhoe (Tripper).[5] Insgesamt überwiegen gramnegative Erreger in rund 86 % der unkomplizierten Infektionen stark gegenüber grampositiven Erregern.[7]
Bei Infektionen, die in Gesundheitseinrichtungen erworben werden, kommt Escherichia coli ebenfalls häufig vor. Es treten hier aber vermehrt Klebsiellen, Proteusarten und Pseudomonaden auf. Die Keime in Gesundheitseinrichtungen sind häufig resistent gegen mehrere Antibiotika. Eine Resistenztestung ist deshalb bei diesen Infektionen unbedingt notwendig.[4]
Als seltene Erreger der Harnwegsinfektionen sind in der Literatur Viren und Protozoen wie Trichomonas vaginalis beschrieben.[5]
Klinische Erscheinungen
Je nachdem wie weit die Infektion im System der Harnwege aufgestiegen ist, gestalten sich die Symptome vielfältig. Ein Befall der Harnröhre selbst löst Schmerzen beim Urinieren (Algurie) oder auch Jucken aus. Bei einer Blasenentzündung (Zystitis) kommen diese Symptome auch vor. Außerdem ist der Harnfluss oft vermindert. Eventuell kann sich eine eitrige (Pyurie) oder blutige (Makrohämaturie) Beimengung im Urin zeigen. Charakteristisch ist auch häufiger Harndrang, bei dem die Patienten aber nur kleine Mengen Urin absetzen (Pollakisurie). Typischerweise tritt bei einer Zystitis eher kein Fieber auf. Bei der akuten Nierenbeckenentzündung stehen Flankenschmerz und Fieber im Vordergrund, Übelkeit und Brechreiz können ebenfalls vorkommen. In der klinischen Untersuchung zeigen sich oft Schmerzen beim Beklopfen des Nierenlagers. Die Nierenbeteiligung kann aber auch vollkommen ohne Symptome verlaufen. So zeigt sich bei rund 30 % der Blasenentzündungen eine symptomlose Nierenbeckenentzündung.
Ist bei Männern die Prostata mit betroffen, zeigen die Patienten oft ein schweres Krankheitsbild mit Schmerzen im Unterbauch, in der Dammregion und Fieber. Bei Kindern, alten Menschen oder Patienten, die ein Nierentransplantat erhalten haben, können die Symptome ganz uncharakteristisch auftreten. So kann sich selbst ein schweres Krankheitsbild mit Nierenbeteiligung nur in Fieber oder Bauchschmerzen äußern. Bei alten Menschen kann Verwirrtheit als einziges Symptom vorkommen. Die Unterscheidung zwischen oberem und unteren Harnwegsinfekt ist anhand der klinischen Symptome nicht sicher möglich.[1][2]
Bei Kindern gestalten sich die Symptome je nach Altersgruppe unterschiedlicher. Dies kann mitunter die Diagnosestellung und adäquate Behandlung entscheidend erschweren. Beim Neugeborenen können Gewichtsverlust, Trinkschwäche, Gelbsucht, grau-blasse Verfärbung der Haut, Störungen des zentralen Nervensystems und Berührungsempfindlichkeit auf einen bereits in die Niere aufgestiegenen Infekt hinweisen. Bei älteren Säuglingen zeigt sich oft hohes Fieber. Nicht selten treten auch Durchfall, Erbrechen und Meningitiszeichen auf. Bei 4–7 % aller Säuglinge mit Fieber ungeklärter Ursache liegt eine Harnwegsinfektion zu Grunde. Kleinkinder zeigen bei unteren Harnwegsinfektionen oft typische Symptome, bei einer Pyelonephritis fehlen diese mitunter. Oft werden in diesem Falle als einziges fassbares Krankheitszeichen Bauchschmerzen angegeben. Den typischen Flankenschmerz, der auf die Nierenbeteiligung hinweist, können Kinder bis zum vierten oder fünften Lebensjahr oft nicht äußern.[8]
Untersuchungsmethoden
Nach der Erhebung der Krankheitsgeschichte (Anamnese) kann bei typischen Symptomen eines unkomplizierten Harnwegsinfekts bei Frauen auf eine weiterführende Diagnostik verzichtet werden. Komplizierte oder im Krankenhaus erworbene Infektionen bedürfen aber weitergehender Untersuchungen. Im Vordergrund steht dabei der Nachweis des Erregers. Eine Untersuchung des Urins mittels eines Teststreifens kann weiße Blutkörperchen (Leukozyten), Nitrit und evtl. vorliegende rote Blutkörperchen nachweisen. Nitrit wird von vielen der infektverursachenden Bakterien (zum Beispiel auch Escherichia coli) gebildet. Das Fehlen von Nitrit schließt einen Infekt jedoch nicht aus. Die weißen Blutkörperchen stellen im Rahmen der Entzündungsreaktion die Antwort des Immunsystems auf den Infekt dar. Im Urinsediment sind die Leukozyten ebenfalls nachweisbar, ab einer Anzahl von zehn weißen Blutkörperchen pro μl gilt der Nachweis als klinisch bedeutsam. Ebenso sind bei dieser mikroskopischen Untersuchung die Bakterien unter Umständen direkt sichtbar. Das Vorhandensein von Leukozytenzylindern weist darauf hin, dass die Infektion bereits in die Niere aufgestiegen ist und eine Pyelonephritis verursacht hat.[1]
Eine weitere Untersuchungsmethode ist die Urinkultur, bei der mit Urin benetzte Agarplatten der Anzucht von Bakterien dienen. Hierfür sollte die Urinprobe als Mittelstrahlurin oder durch Katheterisierung gewonnen werden, um eine mögliche Verunreinigung außerhalb der Harnwege zu vermeiden. Die Urinprobe sollte dabei schnell verarbeitet oder gekühlt werden, um falsch hohe Werte zu verhindern. Häufig werden für die Kultur Eintauchagarplatten verwendet, bei denen die Zahl der Bakterien semiquantitativ ohne weitere Hilfsmittel abgeschätzt werden kann. Ab einer Zahl von 105 koloniebildenden Einheiten pro Milliliter ist von einer bakteriellen Besiedlung auszugehen. Diese signifikante Keimzahl schwankt je nach der Methode der Uringewinnung. Sie ist selbst nur eine relative Größe, und es gilt in jedem Einzelfall nach den Symptomen und Risikofaktoren die Wahrscheinlichkeit eines Harnwegsinfekts abzuwägen. Bei typischen Symptomen kann auch bei geringerer Koloniezahl von einem Infekt ausgegangen werden. Zeigen sich in der Kultur zwei oder mehr verschiedene Keimarten, ist eine Verunreinigung der Probe wahrscheinlich.[1]
Eine Blutuntersuchung kann z.B. bei Fieber sinnvoll sein. Erhöhte Werte des CRP und eine Vermehrung der weißen Blutkörperchen sind ein Zeichen für einen Entzündungsprozess. Die Entnahme einer Blutkultur dient dem Nachweis des Übertritts des Erregers in die Blutbahn, auch kann die Art des Erregers durch die Kultur festgestellt werden. Die Entnahme der Kultur hat vor dem Beginn einer antibiotischen Behandlung zu erfolgen. Ein erhöhter Kreatinin-Wert zeigt eine Funktionsschädigung der Nieren an, die durch einen weit aufgestiegenen Infekt bedingt sein kann. Ist dies der Fall, ist ebenso eine Ultraschalluntersuchung notwendig, um Abflusshindernisse der Harnwege als Ursache auszuschließen.[1]
Behandlung
Unkomplizierter Harnwegsinfekt
Harnwegsinfekte können sehr erfolgreich mit Antibiotika behandelt werden. Das Ziel ist es, die verursachenden Erreger zu beseitigen. Dabei ist eine Einnahme des Antibiotikums kurz vor dem Schlaf optimal, um die Konzentration der Wirksubstanz in der Blase zu erhöhen.[4] Es ist prinzipiell auch möglich die Therapie auf nicht-medikamentöse Maßnahmen (→ Vorbeugung) zu beschränken. Spontanheilungen sind in rund der Hälfte der Fälle zu erwarten. Der Nachteil dieser Methode liegt darin, dass die Patientinnen die Symptome der Erkrankung länger ertragen müssen als unter Antibiotikatherapie[7]
Soll eine medikamentöse Therapie eingeleitet werden, sind laut aktuellen urologischen Leitlinien Fosfomycin, Nitrofurantoin und Pivmecillinam Mittel der ersten Wahl. Dabei wurde insbesondere die geringe Schädigung der Darmflora und damit Resistenzentwicklung herausgestellt. [9] Nitrofurantoin wird nur im Urin ausgeschieden wird und gelingt nicht in das Gewebe der Nieren. Alle drei Medikamente sind relativ preisgünstig und gut verträglich für die körpereigene Bakterienflora. Schwere Nebenwirkungen, unter anderem Lungenentzündungen, Hepatitis oder Polyneuropathien treten nur extrem selten auf. Die Behandlung erfolgt im Rahmen einer Kurztherapie zwischen drei und fünf Tagen. Resistenzen sind sehr selten.[6] Laut der deutschen allgemeinärztlichen Fachgesellschaft wird Trimethoprim trotz leicht steigernder Resistenzraten weiterhin empfohlen.[9]
Das Monopräparat Trimethoprim als Hemmstoff des bakteriellen Folsäurestoffwechsel sowie das Kombinationspräparat Cotrimoxazol, das neben Trimethoprim noch das Sulfonamid Sulfamethoxazol enthält, wird in den Leitlinien nicht mehr empfohlen, insbesondere, da sich doch häufig Resistenzen zeigen. Durch den Sulfonamidanteil treten bei rund 4 % der Patienten allergische Hautreaktionen auf. Außerdem sind Hypoglykämien und medikamenteninduzierte Hautschädigungen (Lyell-Syndrom) möglich. Diesen Nebenwirkungen stünde beim unkomplizierten Infekt keine gesteigerte Wirkung des Kombinationspräparates gegenüber Trimethoprim allein gegenüber.[6] Als weiteres Reservemittel können Fluorchinolone eingesetzt werden.[6] Es gibt auch Veröffentlichungen, die diese als Mittel der ersten Wahl ansehen.[7] Mit ihnen ist ebenfalls eine Behandlung über drei Tage möglich, sie sind aber teurer als andere Medikamente der ersten Wahl. Darüber hinaus sind Fluorchinolone bei Schwangeren nicht anwendbar.[6]
Als unterstützende Allgemeinmaßnahme wird eine Trinkmenge von mindestens eineinhalb Litern pro Tag empfohlen. Dadurch werden die Keime aus den besiedelten Gebieten ausgeschwemmt.[2] Laut den Leitlinien der Deutschen Gesellschaft für Allgemeinmedizin liegen über die häufig verwendeten pflanzlichen Präparate, Tees und Cranberryprodukte keine verlässlichen Studien vor, die deren Effektivität beweisen.[6] Im Bezug auf Cranberrypräparate ist aber eine Verminderung der Adhärenz von Bakterien an den Harnwegsoberflächen nachgewiesen.[10] Eine randomisierte klinische Studie in Finnland zeigte ebenso eine Verminderung des Auftretens von Symptomen einer Harnwegsinfektionen um ein Fünftel.[11]
Die Sinnhaftigkeit einer Untersuchung zur Kontrolle des Therapieerfolgs nach symptomatischer Besserung ist zwischen Leitlinien und Lehrbüchern umstritten.[6] Tritt binnen 48 Stunden keine klinische Besserung ein, so ist vom Versagen des Medikaments auszugehen. In diesem Falle sollte auf ein anderes Mittel umgestellt werden.[4]
Wiederauftretender unkomplizierter Harnwegsinfekt
Bei rund 50 % der Patientinnen tritt innerhalb eines Jahres ein Rezidiv des Infektes auf.[2] Tritt der Infekt binnen 14 Tagen auf, ist von einem Überleben des Erregers trotz klinischer Besserung auszugehen. In diesem Fall sollte mit einem anderen Medikament der ersten Wahl behandelt werden als bei der ersten Therapie, um Resistenzentwicklungen entgegenzuwirken. Die Therapie sollte in diesem Fall auf zehn Tage ausgedehnt werden. Tritt ein Harnwegsinfekt mehr als 14 Tage nach klinischer Abheilung des ersten Infekts auf, ist von einer Neuinfektion auszugehen. Ein Wechsel des Medikaments und eine Verlängerung der Kurzzeittherapie ist dabei nicht notwendig.[6]
Besteht bei einer Patientin ein Zusammenhang zwischen den wiederkehrenden Infekten und Geschlechtsverkehr, kann eine Prophylaxe mit Trimethoprim jeweils nach dem Geschlechtsverkehr abhelfen. Wasserlassen direkt nach dem Beischlaf wirkt dem Aufstieg von Erregern entgegen.[6] Außerdem ist in der Literatur erwähnt, den Urin mit L-Methionin anzusäuern. Das saure Milieu des Urins biete dabei schlechtere Wachstumsbedingungen für Bakterien.[2] Diese Methode wurde bisher allerdings nur in einer kleinen Studie als erfolgreich bestätigt. Große Studien stehen noch aus, so dass die Wirkung der Methionintherapie nicht eindeutig gesichert ist.[7]
Komplizierter Harnwegsinfekt
Im Falle eines komplizierten Infekts ist vor dem Beginn der Antibiotikatherapie eine Urinkultur anzulegen. Die Therapie sollte dann ohne Nachweis eines Erregers mit den Medikamenten der ersten Wahl für mindestens sieben Tage begonnen werden. Sobald der Erregernachweis durch die Kultur vorliegt, sollte falls nötig ein anderes Antibiotikum gewählt werden, das optimal gegen den festgestellten Erreger wirkt. Falls für die komplizierte Infektion eine behandelbare Grunderkrankung ursächlich ist, sollte diese therapiert werden.[6]
Im Falle eines Harnwegsinfekts bei Schwangeren empfiehlt die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften die Gabe von Cephalosporinen oder Amoxicillin als Medikamente der ersten Wahl.[12]
Asymptomatische Bakteriurie
Finden sich in der Urinuntersuchung Bakterien in signifikanter Keimzahl, aber keine Symptome eines Harnwegsinfekts, so wird von einer asymptomatischen Bakteriurie gesprochen. Diese ist bei Schwangeren behandlungsbedürftig. Nach erfolgreicher Therapie sollte bis zur Entbindung eine monatliche Kontrolle des Urins auf Bakterien erfolgen, um Schäden für das Kind auszuschließen.[6] Ebenso sollten Patienten mit Immunsuppression, Harnabflusshindernissen oder Patienten vor TURP behandelt werden.[13]
Pyelonephritis
Ist ein Harnwegsinfekt so weit fortgeschritten, dass er zu einer Nierenbeckenentzündung geführt hat, ist das Kombinationspräparat Cotrimoxazol Mittel der ersten Wahl. Es sollte über mindestens 14 Tage eingesetzt werden. Als Mittel der zweiten Wahl sind Chinolone beschrieben.[6] Darüber hinaus wird in der Literatur auch der Einsatz von Kombinationen mehrere Antibiotika empfohlen. Mögliche Kombinationen bestehen aus einem Aminoglykosid und einem Breitspektrum-Penicillin oder aus einem Breitspektrum-Cephalosporin mit einem Acylaminopenicillin.[2] Schwangere, Kinder und je nach klinischem Bild andere Patienten mit kompliziertem Infekt sollten stationär in einem Krankenhaus behandelt werden, insbesondere um eine intravenöse Anfangstherapie zu ermöglichen. Kommt es infolge der Pyelonephritis zu Komplikationen wie einer Harnabflussstörung oder der Bildung eines Abszess so ist eine operative Therapie angezeigt.
Urethritis
Tritt eine isolierte Entzündung der Harnröhre auf, liegt häufig ein Infekt mit Chlamydien zugrunde, der per Abstrich nachgewiesen werden kann. Die Therapie eines Chlamydieninfekts besteht vorzugsweise in einer siebentägigen Gabe von Doxycyclin. Schwangere dürfen mit diesem Medikament nicht behandelt werden. Sie können mit einer Einmaldosis Azithromycin oder einem Cephalosporin behandelt werden. Da Chlamydien vorwiegend sexuell übertragen werden, ist eine Mitbehandlung des Sexualpartners, auch wenn dieser keine Symptome aufweist,[6] ebenso wie bei einer Gonorrhöe zwingend notwendig. Eine mögliche Therapie ist die Einmalgabe von Ampicillin oder Amoxicillin. Es kann aber auch eine siebentägige Behandlung mit Tetracyclin oder Doxycyclin erfolgen. Auch Gyrasehemmer sind als wirksam beschreiben worden.[5]
Virale Harnwegsinfekte
Selten sind virale Harnwegsinfekte. Als auslösende Viren sind Adenoviren, Zytomegalieviren und BK-Viren aus der Gattung der Polyomaviren beschrieben. Sie führen in vielen Fällen zu einer hämorrhagischen Verlaufsform. Der Nachweis der Viren erfolgt über die Polymerasekettenreaktion. Als therapeutischer Ansatz ist Cidofovir in der Diskussion.[14]
Vorbeugung
Zur Vorbeugung und auch zur Besserung der Symptome werden weiterhin in der medizinischen Literatur zahlreiche Maßnahmen empfohlen. Eine ausreichende Trinkmenge von rund 2 l pro Tag wird angeraten, falls keine Vorerkrankungen vorliegen, die dagegen sprechen. Außerdem soll der Harndrang nicht unterdrückt werden. Die Blase soll beim Wasserlassen möglichst vollständig entleert werden. Zur Verminderung der Infektionen nach dem Beischlaf wird Wasserlassen direkt danach empfohlen. Verstopfungen stehen im Verdacht, Harnwegsinfekte zu fördern und sollten deshalb behandelt werden. Außerdem soll die Hygiene im Intimbereich nicht übertrieben werden, da dadurch die normale Keimflora zerstört werden kann. Bei wiederholten Infektionen bei Frauen wird ein Wechsel der Methode der Empfängnisverhütung nahegelegt. Außerdem sollen gefährdete Personen Nässe und Unterkühlung meiden. Die Wirksamkeit dieser Strategien der nicht-medikamentösen Prophylaxe ist allerdings bisher nicht durch valide Studien nachgewiesen worden.[7]
Medizingeschichte
Der römische Arzt Rufus von Ephesus beschrieb im zweiten Jahrhundert nach Christus Blasenentzündungen als meist schnell tödlich endende Krankheit. Darüber hinaus behauptete er, Hippokrates wäre im Stande gewesen, Nierenentzündungen durch die Eröffnung der Niere zu heilen.[15]
Einzelnachweise
- ↑ a b c d e f g Herbert Renz-Polster, Steffen Krautzig: Basislehrbuch Innere Medizin, München, Jena 2008, S. 941-950
- ↑ a b c d e f g h i j M. Gimdt, E. Wandel, H. Köhler: Nephrologie und Hochdruck in Hendrik Lehnert, Karl Werdan (Hrsg.): Innere Medizin - essentials, 4. Auflage, Stuttgart 2006, S. 530f
- ↑ P Gastmeier et al.: Prevalence of nosocomial infections in representative German hospitals, J Hosp Infect. 1998 Jan;38(1):37-49, PMID 9513067
- ↑ a b c d e f g G. Weiss, H. Pall, M. Dierich in Wolfgang Gerok et al. (Hrsg.): Die Innere Medizin, Stuttgart 2007, S. 1338f
- ↑ a b c d e f H. Huland, S. Conrad: Harnwegsinfektion in Richard Hautmann, Hartwig Huland: Urologie, 3. Auflage, Heidelberg 2006, S. 134-148
- ↑ a b c d e f g h i j k l m n Leitlinie Brennen beim Wasserlassen der Deutschen Gesellschaft für Allgemeinmedizin (DEGAM), online abrufbar (als pdf ), zuletzt abgerufen am 17. Juni 2008 16.46 Uhr
- ↑ a b c d e f g G. Stein, R. Fünfstück: Medikamentöse Therapie von Harnwegsinfekten. In: Der Internist, Springer, Berlin, Heft Volume 49, 6 / Juni 2008, S. 747-755, PMID 18327562
- ↑ Rolf Betz et al.: Harnwegsinfektionen im Säuglings- und Kindesalter - Consensus Empfehlungen zu Diagnostik, Therapie und Prophylaxe, Chemother J, 2006;15:163-171, Online abgerufen als pdf am 31. Mai 2008
- ↑ a b S3-Leitlinie: "Epidemiologie, Diagnostik, Therapie und Management unkomplizierter bakterieller ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten", online abrufbar als pdf ;zuletzt abgerufen am 3. Oktober 2011
- ↑ Di Martino P, Agniel R, David K, Templer C, Gaillard JL, Denys P, Botto H: Reduction of Escherichia coli adherence to uroepithelial bladder cells after consumption of cranberry juice: a double-blind randomized placebo-controlled cross-over trial., World Journal of Urology, Februar 2006, Volume 24, Nummer 1, S. 21-27 PMID 16397814
- ↑ Kontiokari T, Sundqvist K, Nuutinen M, Pokka T, Koskela M, Uhari M: Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women, British Medical Journal, June 30; 322(7302): 1571, PMID 11431298
- ↑ Leitlinie Harnwegsinfekt der Frau der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften, online abrufbar als [1] zuletzt abgerufen am 1. Juli 2011
- ↑ Gerd Herold und Mitarbeiter : Innere Medizin, Köln, 2011, S.599 - 605
- ↑ Paduch DA: Viral lower urinary tract infections, Current Urology Reports, 2007 Jul;8(4):324-35; PMID 18519018
- ↑ Jürgen Konert, Holger Dietrich: Illustrierte Geschichte der Urologie, Berlin, 2004, S. 21
Literatur
Leitlinien
- Leitlinie Harnwegsinfektionen bei erwachsenen Patienten, unkomplizierte bakterielle ambulant erworbene: Epidemiologie, Diagnostik, Therapie und Management der Deutschen Gesellschaft für Urologie (federführend) vom 1. Juni 2010 , gültig bis 30. Juni 2015, dazu ein Kommentar im Deutschen Ärzteblatt
- Leitlinie Brennen beim Wasserlassen der Deutschen Gesellschaft für Allgemeinmedizin (DEGAM), online abrufbar (pdf ), zuletzt abgerufen am 22. Mai 2008
- K. Tamussino et al.: Harnwegsinfekt, Leitlinie der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, 2006 (html) zuletzt abgerufen am 7. Juni 2008
- M. Grabe et al.: Guidelines on The Management of Urinary and Male Genital Tract Infections. European Association of Urology, 2008
- K. Naber et al : "Epidemiologie, Diagnostik, Therapie und Management unkomplizierter bakterieller ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten", S3-Leitlinie von 2010 unter Federführung der Deutschen Gesellschaft für Urologie; online abrufbar als pdf ; zuletzt abgerufen am 3. Oktober 2011
Weitere Publikationen
- M. Gimdt, E. Wandel, H. Köhler: Nephrologie und Hochdruck in Hendrik Lehnert, Karl Werdan (Hrsg.): Innere Medizin - essentials, 4. Auflage, Stuttgart 2006
- H. Huland, S. Conrad: Harnwegsinfektion in Richard Hautmann, Hartwig Huland: Urologie, 3. Auflage, Heidelberg 2006, S. 134-148
- G. Weiss, H. Pall, M. Dierich in Wolfgang Gerok et al. (Hrsg.): Die Innere Medizin, Stuttgart 2007, S. 1338f
- G. Stein, R. Fünfstück: Medikamentöse Therapie von Harnwegsinfekten. In: Der Internist, Springer, Berlin, Heft Volume 49, 6 / Juni 2008, S. 747-755
- Schmiemann, Guido et al.: Diagnose des Harnwegsinfekts: Eine systematische Übersicht. In: Dtsch Arztebl Int. Nr. 107(21), 2010, S. 361-367 ([2] ).
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Milzbrand
Milzbrand oder Anthrax ist eine Infektionskrankheit, die durch Bacillus anthracis verursacht wird und meist Paarhufer befällt. Der deutsche Name leitet sich von der braunschwarzen Verfärbung einer schwer befallenen Milz ab.[1] Der Erreger des Milzbrands ist ein aerobes und sporenbildendes Stäbchenbakterium und wurde 1849 durch Aloys Pollender entdeckt. Die Sporen können unter Umständen Jahrzehnte oder sogar Jahrhunderte überleben.
Menschen können auch befallen werden, wenn sie hohen Dosen der Milzbrandsporen ausgesetzt sind. Eine Übertragung von Mensch zu Mensch gilt als sehr unwahrscheinlich; es wurde bislang kein solcher Fall dokumentiert.
Erreger
Der Milzbranderreger, Bacillus anthracis, gehört zur Gattung Bacillus (sporenbildende, aerobe Stäbchenbakterien) innerhalb der Familie Bacillaceae. Er ist ein etwa fünf bis sechs µm (1 µm = 0,001 mm) langes, gram-positives, unbewegliches, sporenbildendes Stäbchen, das in Körperflüssigkeiten kurze, in der Kultur längere kettenförmige Verbände bildet. Im Tierkörper ist die Bakterienzelle von einer deutlichen Kapsel umhüllt, während in der Kultur in der Regel keine Kapselbildung erkennbar ist. Außerhalb des Tierkörpers, in Anwesenheit von Sauerstoff und bei Temperaturen von 12 bis 43 °C, bilden sich Sporen (Dauerformen), deren Größe etwa 0,5 bis 1,2 µm beträgt.
Das Bakterium selbst ist nicht sehr widerstandsfähig. Im faulenden, nicht geöffneten Kadaver gehen die Keime bei warmer Witterung bereits nach zwei bis drei Tagen zugrunde. Bei niedrigen Temperaturen können sie über zwei Wochen infektiös bleiben. Im Magensaft werden sie nach etwa 20 Minuten abgetötet. Die Sporen des Milzbranderregers sind hingegen außergewöhnlich unempfindlich. Durch Eintrocknen werden sie nicht vernichtet. Durch Sonneneinstrahlung werden sie innerhalb von vier Tagen abgetötet. Im Erdreich und vor Sonne geschützt bleiben sie über viele Jahrzehnte hinweg lebensfähig. Zehnprozentiges Formaldehyd ist nach etwa zwei Stunden, 20-prozentiges Formaldehyd in etwa zehn Minuten wirksam. Im strömenden Dampf von 100 °C gehen sie nach fünf Minuten, in trockener Hitze von 120 °C bis 140 °C nach drei Minuten zugrunde.
Verbreitung
Milzbrand kommt in allen Ländern und in allen Erdteilen, allerdings in stark variierender Häufigkeit, vor. Am häufigsten tritt Milzbrand in wärmeren Regionen, vor allem in Südeuropa, im Nahen Osten, in Asien, Nordafrika und Südamerika auf. Er findet sich bevorzugt auf feuchten, sumpfigen Böden und in Überschwemmungsgebieten von Fluss- und Bachläufen, in denen die Sporen durch das Wasser verschleppt und ausgebreitet werden können. Selbst aus tief vergrabenen Kadavern können durch steigendes Grundwasser noch nach Jahrzehnten immer wieder Sporen an die Oberfläche gelangen. Wenn im Zuge von Baumaßnahmen die Areale ehemaliger Abdeckereien und Wasenmeistereien angeschnitten werden, die vor Jahrzehnten noch weit außerhalb der Siedlungsperipherie lagen, können Sporen wieder nach oben befördert werden.
Die Mehrzahl der Milzbrandfälle wurde in Gebieten mit Grünland- und Weidewirtschaft festgestellt. Jahreszeitlich zeichnet sich ein Höhepunkt im Frühjahr ab, während der statistische Tiefpunkt im Sommer (Juni) liegt. Auch in Jahren mit extrem hohen Niederschlagsmengen muss mit vermehrten Krankheitsfällen gerechnet werden.
Als Krankheit und bösartige Seuche ist der Milzbrand schon seit dem Altertum bekannt. Sowohl in der Bibel als auch bei Griechen (Homer) und Römern (Ovid) wird davon berichtet. Die alten arabischen Ärzte bezeichneten den Milzbrand beim Menschen als „persisches Feuer”.
Auch als Wildkrankheit ist der Milzbrand seit langem bekannt. Schon aus dem neunten Jahrhundert wird über regelrechte Seuchenzüge berichtet. Nachdem infolge der fortschreitenden Erkenntnisse der Mikrobiologie die Seuche in den Haustierbeständen zurückgedrängt werden konnte, wurde sie auch beim Wild in den letzten Jahrzehnten nur noch vereinzelt festgestellt.
Im Hinblick auf das Vorkommen bei verschiedenen Haus- und Wildarten sowie beim Menschen spielt deren unterschiedlich stark ausgeprägte Empfänglichkeit eine Rolle. Hoch empfänglich sind Schaf, Ziege, Rind, Büffel, Pferd, Kamel, Rentier, Elefant und Nerz; mittelmäßig empfänglich Hund, Katze, Ratte und Mensch. Wenig empfänglich ist das Schwein und fast resistent sind Vögel (mit Ausnahme des Straußes).
In Deutschland tritt Milzbrand nur noch sehr selten auf. In der Vergangenheit war sein Auftreten meistens an die Einfuhr infizierter Tiere oder an den Import von Tierhäuten (vor allem aus veterinärärztlich unkontrollierten Schlachtungen) für die Lederherstellung, von Fellen und von Haaren und Borsten gebunden. So überleben Milzbrandsporen die Lederkonservierung und den Gerbprozess und gelangten über die Gerbereiabwässer in die Gewässer und bei Überschwemmungen in die betroffenen Flussniederungen und Weiden. Es sind zahlreiche historische Milzbrandepidemien bei Haustieren im Abstrom von Gerbereien bekannt. Diese Tierepidemien gingen zu Beginn des 20. Jahrhunderts nach zum Teil heftigen Protesten betroffener Bauern zurück, nachdem vielerorts die Direkteinleitung von Gerbereiabwässern untersagt wurde und die Abwässer stattdessen grob geklärt und verrieselt wurden.
Milzbrand beim Menschen trat vor allem als Berufskrankheit bei Gerbereiarbeitern, bei Personal aus der Verarbeitung von Fellen, Borsten und Haaren, aber auch bei Hafenarbeitern und Transportarbeitern, die Umgang mit diesen Materialien hatten, auf, daneben auch bei Abdeckereien. Höhepunkte des Auftretens waren Krisenzeiten der Lederindustrie, als vermehrt billige Importe aus Regionen ohne oder mit geringer veterinärärztlicher Kontrolle der Schlachtungen erfolgten. Mit dem Rückgang der Produktion in diesen Gewerbezweigen und mit der zunehmenden veterinärärztlichen Kontrolle in den Herkunftsländern der Tierprodukte nahmen die Erkrankungsfälle so weit ab, dass Milzbrandfälle heute äußerst selten geworden sind.
Bei der Altlastenuntersuchung von Altstandorten der Lederindustrie gelten diese als potentiell milzbrandkontaminiert. Bei einem entsprechenden Forschungsvorhaben[2] konnten in Deutschland in Einzelfällen auch noch über 40 Jahre nach Betriebsschließung virulente Milzbrandsporen nachgewiesen werden. Andererseits sind nach den Erhebungen dieses Forschungsvorhabens keine Fälle einer Erkrankung an Milzbrand bei Mensch oder Tier wegen eines Kontaktes mit entsprechenden Altlastmaterialien bekannt. Auch kann das Milzbrandrisiko als weitgehend ausgeräumt gelten, wenn historische Erhebungen und Zeitzeugenaussagen bestätigen, dass bei der ehemaligen Produktion keine Milzbranderkrankungen aufgetreten sind, und vor allem auch, wenn nur inländische Häute aus veterinärärztlich kontrollierten Schlachtungen verwendet wurden.
Milzbrand ist beim Tier eine anzeigepflichtige Tierseuche und beim Menschen eine meldepflichtige Krankheit nach §6 Abs. 1 des Infektionsschutzgesetzes (Meldepflicht bei Verdacht, Erkrankung und Tod). Bei beruflicher Exposition muss auch die Berufsgenossenschaft informiert werden. Bei Arbeiten im Altlastenbereich mit Milzbrandverdacht ist das berufsgenossenschaftliche Merkblatt BGI 583 „Biologische Arbeitsstoffe bei der Bodensanierung” zu beachten.
Manifestationsformen und Symptome
Hautmilzbrand
Hautmilzbrand ist die harmloseste Form des Milzbrandes. Er wird nur durch direkten Hautkontakt übertragen, unbehandelt enden 5 bis 20 % der Fälle tödlich. Wenn es zu einer Infektion kommt, bildet sich an der Stelle der Übertragung ein bläschengesäumtes Ulkus mit einer schwarzen Nekrose in der Mitte. Daraus entwickelt sich ein eitergefülltes Bläschen. Bei einer weiteren Ausdehnung der Krankheit treten neue Bläschen auf. Wenn diese Bläschen sich verbinden, entsteht ein Milzbrandkarbunkel, welches, wenn es Anschluss an ein Blutgefäß bekommt, zu einer Blutvergiftung führen kann. Hautmilzbrand wird mit systemischem Penicillin G behandelt. Haut- und Lungenmilzbrand waren früher häufige Berufskrankheiten von Fleischern und insbesondere Gerbern.
Lungenmilzbrand
Für eine Infektion müssen ca 3000-9000 Milzbrandsporen mit der Atemluft inhaliert werden, die an Tierhäuten oder Tierhaaren haften und noch nach Jahren ansteckend sind. Die Inkubationszeit beträgt einige Tage bis zu mehrere Wochen. Die Krankheit beginnt unspezifisch und grippeähnlich mit Husten, es folgen hohes Fieber, Schüttelfrost und Atemnot. Das ausgehustete Sekret ist hochinfektiös. Auch mit sofortiger antibiotischer Therapie ist die Letalität (Sterbensrate) an Lungenmilzbrand sehr hoch, da mit dem Auftreten der Symptome eine massive Freisetzung der Milzbrandtoxine bereits stattgefunden hat. Der Tod tritt meistens innerhalb von drei bis sechs Tagen unter dem Bild eines septischen Schocks ein.
Darmmilzbrand
Durch den Genuss von infizierten Milchprodukten oder infiziertem Fleisch wird Darmmilzbrand übertragen. Die Inkubationszeit beträgt wenige Stunden bis 3 Tage. Es treten blutiges Erbrechen und blutiger Durchfall auf, welche Zeichen einer blutigen Darmentzündung sind. Die Keime verbreiten sich über den ganzen Körper, es kann zu einer Blutvergiftung und einem Herz- und Nierenversagen kommen. Über 50 % der Erkrankten sterben. Dies ist die seltenste Form von Milzbrand. Darmmilzbrand wird mit Breitbandantibiotika wie Ciprofloxacin behandelt. Auch kann ein oropharyngealer Milzbrand nach oraler Aufnahme von Milzbrandsporen entstehen (Ödeme und Nekrosen im Halsbereich).
Diagnostik
Beim Patientengespräch muss der Krankheitsverlauf der letzten Tage besonders sorgfältig erkundet werden (Anamnese). Wichtig für den Arzt sind Hinweise auf eine mögliche berufliche Exposition und auf Tierkontakte. Für die Diagnose des Hautmilzbrandes ist eine Untersuchung der oben genannten typischen Hautveränderungen am gesamten Körper des Patienten erforderlich.
Zur Absicherung werden die Anthrax-Bazillen aus den Hautschäden oder bei Verdacht auf Lungenmilzbrand aus dem Auswurf gewonnen und mikrobiologisch untersucht. Gegebenenfalls wird auch eine Blutprobe untersucht. Für den Erregernachweis kommen drei Methoden in Frage. Zum einen wird der Erreger direkt mikroskopisch nachgewiesen. Zum anderen kann der Nachweis anhand einer Bakterienkultur erfolgen. Zum dritten ist ein moderner, gentechnischer Nachweis mit der PCR möglich. Dazu wurde in jüngster Zeit auch ein Schnelltest entwickelt.
Vorbeugung
Besteht der Verdacht, dass eine inhalative Milzbrandexposition stattgefunden hat, wird eine 60-tägige medikamentöse Prophylaxe (bzw. 100-tägige Prophylaxe nach den Empfehlungen der US-Gesundheitsbehörde CDC) mit einem Antibiotikum Ciprofloxacin, Doxycyclin oder Amoxicillin empfohlen.
Einsatz als biologische Waffe
Die Meinungen von Experten, inwieweit Milzbrandbakterien für die biologische Kriegführung geeignet sind, gehen auseinander. Basierend auf Versuchen mit Primaten schätzen Forscher die letale Dosis LD50 auf 2.500 bis 55.000 inhalierte Sporen.[3]
Die Sporen sind gegen äußere Einflüsse unempfindlich und deshalb zum Beispiel deutlich geeigneter als das Pestbakterium Yersinia pestis.
Geschichte
Im Mittelalter wurde bei kriegerischen Auseinandersetzungen verseuchte Tierkadaver über Burgmauern geworfen, um die gegnerische Bevölkerung zu infizieren.
Milzbranderreger wurden erst 1849 in Schafsblut entdeckt. Robert Koch untersuchte die Erreger 1877, beschrieb sie, konnte sie in Kultur vermehren und ihre Rolle bei der Entstehung der Krankheit nachweisen.
Im Ersten Weltkrieg wurde von deutschen Wissenschaftlern mit Milzbrand experimentiert. Die Versuche wurden wegen geringen Erfolges wieder eingestellt.
Die Kaiserlichen Streitkräfte Japans setzten Anthrax 1932 in der Mandschurei ein. Bei einem sogenannten Forschungsprojekt der Einheit 731 wurden zirka 3000 Kriegsgefangene als Versuchsobjekte missbraucht. Auch andere Kampfstoffe wurden getestet.
Im Zweiten Weltkrieg entwickelte Frankreich einen Milzbranderreger. Dieser wurde beim Einmarsch der deutschen Truppen entdeckt und deutsche Wissenschaftler experimentierten mit dem Erreger, obwohl Hitler es ausdrücklich verboten hatte. Angeblich sollen die USA während des Zweiten Weltkrieges an Milzbrandbomben gearbeitet haben. 1942 hat Großbritannien auf der Insel Gruinard Island Milzbranderreger getestet, die Insel war fast fünfzig Jahre lang Sperrgebiet. Zwar wurde die Insel 1986 und 1987 mit insgesamt 280 Tonnen Formaldehyd entseucht, es besteht aber noch Kritik an der Gründlichkeit und Wirksamkeit dieser Maßnahme.
1970er-Jahre
Auch die Sowjetunion experimentierte mit Milzbrand. Im April 1979 infizierten sich beim Milzbrand-Unfall in Swerdlowsk in einer B-Waffen-Forschungsstätte zahlreiche Anwohner mit Milzbrand. Die Infizierten befanden sich zu dem Zeitpunkt in der Windrichtung, als vermutlich nur zirka ein Gramm des Milzbrand-Erregers freigesetzt wurde. Erst als 1992 unter Boris Jelzin der Betriebsunfall publik wurde, wussten die Familien der Verstorbenen, wodurch ihre Familienmitglieder zu Tode gekommen waren. Die Zeitschrift Science publizierte 1994 die Ergebnisse der amerikanisch-russischen Untersuchungskommission[4] – es ist die bislang gründlichste Dokumentation einer B-Waffen-Wirkung.
Die gesamte im Aralsee liegende Insel der Wiedergeburt ist mit Anthrax verseucht. Sie war ein geheimes Versuchsgebiet der sowjetischen Armee; angeblich sollen dort noch 1988 Milzbranderreger ausgesetzt worden sein. Durch die Wasserentnahme aus den Zuflüssen des Aralsees ist der Wasserspiegel aber mittlerweile so weit gesunken, dass sich im Jahr 2000 die ehemalige Insel mit dem Festland verband.
1972 unterschrieben 143 Staaten die Biowaffenkonvention, welche die Entwicklung, Herstellung und Lagerung biologischer Waffen untersagt.
1990er-Jahre
In den 1990er Jahren wurde der Unfall von Swerdlowsk öffentlich bekannt und auch, dass der Irak große Mengen Milzbrand-Erreger zum Einfüllen in Sprengköpfe und Bomben lagerte. Daraufhin begann man mit Verhandlungen über ein Zusatzprotokoll, die nach sechs Jahren endeten. Dieses Protokoll lässt immer noch viele Lücken offen, und da Inspektionen in Fabriken lange im Voraus angekündigt werden müssen, können Spuren beseitigt werden. Die USA stiegen aus dem Zusatzprotokoll aus mit der Begründung, es gehe nicht weit genug. Die USA selbst betreiben Forschung auf dem Gebiet der Abwehr von biologischen Gefahren. Hierzu gehört z. B. die Entwicklung von Impfstoffen oder diagnostischer Tests.
Die vermutete Herstellung und Lagerung unter anderem von Biowaffen als Massenvernichtungswaffen im Irak-Konflikt diente den USA nach einem Tauziehen über Waffeninspektionen im Jahre 2003 als wesentliche Legitimation, den Irak-Krieg zu beginnen. Es stellte sich später heraus, dass diese Vermutungen oder vermeintlichen Beweise jeder Grundlage entbehrten.
2000er-Jahre
Im Juli 2001 waren in Kanada im Bundesstaat Alberta Hunderte von Bisons bedroht. 19 Tiere starben an den Folgen des Erregers.
Am 12. Juli 2001 traten in Südkorea im Landkreis Changyong in der Provinz Gyeongsangnam-do fünf Milzbrandfälle unter Menschen auf, eine Person starb. Alle hatten Fleisch von einem Rind verzehrt, das in einem Sumpfgebiet tot aufgefunden worden war.
Im September 2001 wurden bei Anthrax-Anschlägen in den Vereinigten Staaten Briefe mit Milzbranderregern an Regierungsstellen und hohe Politiker verschickt. Fünf Menschen starben. Ein vermuteter Zusammenhang mit den Terroristen vom 11. September konnte nicht bewiesen werden. Stattdessen wird inländisches Laborpersonal verantwortlich gemacht, da die verschickten Milzbranderreger den eigens herangezüchteten Stämmen aus dem Labor für Biokampfstoffe in Fort Detrick entsprachen. Dr. Bruce Ivins, ein verdächtiger US-Wissenschaftler, der Selbstmord begangen haben soll, wird von den US-Behörden als Einziger verantwortlich für die US-Anschläge gehalten, wie US-Staatsanwalt Jeffrey Taylor am 6. August 2008 verlautbarte. Weitergehende öffentliche Untersuchungsergebnisse sind seither nicht bekannt.[5] Im Zusammenhang mit den Milzbrand-Briefen in den USA wurden am 18. Oktober 2001 auch in Kenia Sporen des Milzbrand-Erregers in einem Brief an einen Privatmann nachgewiesen.
2008 gab es eine Häufung von Milzbrandfällen bei Rindern im ostfranzösischen Département Doubs, nachdem die Krankheit dort über 40 Jahre praktisch nie vorkam. Bis August 2008 wurde die Erkrankung in 21 Rinderbetrieben festgestellt, 40 Tiere mussten getötet werden.[6]
2009 wurden in New York mehrere Botschaften unter dem Verdacht des Milzbrandes evakuiert. Diese bekamen einen Brief aus Texas mit weißem Pulver. Die Botschaftsmitarbeiter wurden vorsorglich dekontaminiert. Das Pulver stellte sich als Mehl heraus.
2010 kam es durch milzbrandverseuchtes Heroin zu sieben Todesfällen in Schottland und einem Todesfall in Deutschland.[7]
2010 wurde Anfang April im Raum Aachen eine Hautmilzbrand-Infektion bekannt.[8]
2010 wurden im August und September in Bangladesch rund 300 Personen mit Milzbrand infiziert. Außerdem erkrankten über 200 Kühe und Ziegen, 50 Tiere starben.[9]
Zivile Forschung
Aufgrund der militärischen Forschung als Biowaffe und deren Abwehr ist die Wirkungsweise des Anthrax-Erregers und der Verlauf der Krankheit gut erforscht. Unter anderem wird daran geforscht, die Wirkung als Zellgift selektiv gegen Krebszellen einzusetzen.[10]
Literatur
- R. C. Spencer: Bacillus anthracis. . In: Journal of clinical pathology (J Clin Pathol). London 56.2003,3(Mar),182–187. Review. PMID 12610093 . ISSN 1472-4146
- W. Biederbick, R. Fock, K. Güttler, C. Veit: Infektionen durch Bacillus anthracis. In: Dtsch. med. Wochenschr. Stuttgart 15.2002,127, 809–814. ISSN 0012-0472
Einzelnachweise
- ↑ http://www.xxx
- ↑ Umweltbundesamt (Hrsg.): Leitfaden – Erkundung ehemaliger Gerbereistandorte. 1998. Projektträger: Abfallwirtschaft und Altlastensanierung, Landesamt für Natur und Umwelt des Landes Schleswig-Holstein, Abteilung Geologie/Boden, Dezernat Altlasten.
- ↑ T.V. Inglesby et al.: Anthrax as a Biological Weapon. In: Journal of the American Medical Association. 18, Nr. 281, 1999, S. 1735-1745 (PMID 10328075 ).
- ↑ M. Meselon, J. Guillemin, M. Hugh-Jones, A. Langmuir, I. Popova, A. Shelokov, O. Yampolskaya: The Sverdlovsk anthrax outbreak of 1979. Science 266:1202–1208, 18. Dezember 1994.
- ↑ Nachrichtenticker
- ↑ Milzbrand in Ostfrankreich. Dt. TÄBl. Heft 11 (2008), S. 1542
- ↑ Acht Tote durch Milzbrand-verseuchtes Heroin. Welt-Online, 19. Januar 2010, abgerufen am 20. Januar 2010.
- ↑ http://www.xxx Leichter Fall von Milzbrand
- ↑ Officials work to control anthrax outbreak in Bangladesh. Abgerufen am 6. September 2010.
- ↑ Shihui Liu, Hannah Aaronson, David J. Mitola, Stephen H. Leppla, Thomas H. Bugge: antitumor activity of a urokinase-activated engineered anthrax toxin . The National Academy of Sciences, 2003.
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Legionellose - Legionärskrankheit
(Weitergeleitet von Legionärskrankheit)
Bei einer Legionellose handelt es sich um eine Infektionskrankheit, die durch Bakterien der Gattung Legionella (Legionellen) hervorgerufen wird. Der mit Abstand häufigste Erreger (90 % bis 95 % der Fälle[1]) ist Legionella pneumophila.
Es können mehrere Formen der Legionellose unterschieden werden. Die beiden wichtigsten Formen sind die Legionärskrankheit, die durch eine Tröpfcheninfektion hervorgerufene Lungenentzündung (Pneumonie) gekennzeichnet ist und einen lebensgefährlichen Verlauf annehmen kann, sowie das seltenere, ohne Lungenentzündung und meist mild verlaufende Pontiac-Fieber. Darüber hinaus können Legionellen in seltenen Fällen auch Infektionen außerhalb der Atemwege wie Wund-, Herzinnenhaut- (Endokarditiden) und Nierenbeckenentzündungen (Pyelonephritiden) verursachen.
Geschichte
Die Legionärskrankheit wurde 1976 zum ersten Mal beschrieben. Ihren Namen erhielt sie nach einem Treffen der US-Kriegsveteranenvereinigung „American Legion state convention“, das vom 21. bis 24. Juli 1976 in einem Hotel in Philadelphia stattfand. Damals waren 181 Personen an der lebensbedrohlichen Lungenentzündung erkrankt. Sie alle waren entweder Besucher des Kriegsveteranentreffens oder Besucher des Hotels. Die Epidemie mit damals unbekannter Ursache alarmierte die amerikanischen Gesundheitsbehörden sowie die Centers for Disease Control and Prevention in Atlanta, so dass mit der Erforschung der Krankheitsursache begonnen wurde. 1978 waren es Charles C. Shepard und Joseph E. McDade, die Legionella pneumophila als Erreger identifizieren konnten. Dieser hatte sich in der Klimaanlage des Hotels angesiedelt. Nachträglich wurden einige andere Epidemien auf die Legionärskrankheit zurückgeführt, wie beispielsweise eine am St. Elisabeth's Hospital in Washington, bei der 1965 acht Menschen starben.[2]
Das Pontiac-Fieber wurde bereits im Jahre 1968 beschrieben. Die Erkrankung erhielt ihren Namen nach einem Ausbruch in der Stadt Pontiac in Michigan.[3]
Ursachen für Legionellenprobleme
Eine erhöhte Koloniezahl im Trinkwasser beruht zumeist auf fehlender Zirkulation des Wassers. In zu großen Warmwasserspeichern oder Rohrleitungen verbleibt das Wasser länger und die Organismen entwickeln sich besser als in fließendem Wasser. Auch bei zeitweise geringer oder fehlender Wasserentnahme kommt es zu stehendem Wasser, das das Wachstum begünstigt. Wenn der Warmwasserkreislauf nicht zirkuliert, entstehen Zonen mit Temperaturen, die ein Wachstum erleichtern.
Maßnahmen gegen die Ausbreitung von Legionellen
Bauvorschriften
Kunststoffe müssen die Wasservorschriften der DVGW W 270 erfüllen, damit keine Nährstoffe aus den Rohren oder Geräten ins Wasser gelangen.
Das DVGW-Arbeitsblatt W 551 fordert am Wasseraustritt eine Temperatur des Warmwassers von 60°C, dadurch soll das Wachstum der Bakterien durch ungünstige Bedingungen behindert werden. Neben dem § 37 des Infektionsschutzgesetzes fordert auch die Trinkwasserverordnung (TrinkwV 2001, novelliert 2011) in §6 die Freiheit des Trinkwassers von Krankheitskeimen, hinzu kommen die anerkannten Regeln der Technik die in der DIN-Vorschrift 1988 und in DVGW-Vorschriften festgeschrieben sind. Das sind die Arbeitsblätter W 551 Technische Maßnahmen zur Verminderung des Legionellenwachstums und W 553 Bemessung von Zirkulationssystemen in zentralen Trinkwassererwärmungsanlagen und die VDI-Vorschrift 6023 Hygiene in Trinkwasser-Installationen. Zulässige Stoffe und Verfahren zur Abwehr sind in einer aktualisierten Liste des Umweltbundesamtes nach § 11 TrinkwV 2001 beschrieben.[4] So sind Totleitungen wegen des stagnierenden Wassers zu beseitigen; enthärtetes Wasser bietet den Legionellen weniger Nährstoffe. Die 1. Novellierung der TrinkwV wurde im Mai 2011 verkündet und trat am 1. November 2011 in Kraft.[5]
Thermische Desinfektion
Dazu sind alle Zapfstellen für drei Minuten mit heißem Wasser von 70 °C zu betreiben.
Chemische Desinfektion
Meist wird mit Chlor, Chlordioxid oder Natrium- und Calciumhypochloritlösungen desinfiziert, seltener wird Ozon wegen des Aufwandes in der Trinkwasserhygiene genutzt. Eine Spülung der Leitung soll den Vorrang haben vor dem Einsatz von Chemikalien.
UV-Desinfektion
Durch Bestrahlen mit UV-C-Licht (Wellenlänge 254 nm) werden Bakterien inaktiviert, allerdings können Legionellen in Amöben überleben. Zur Verbesserung der Wirkung kann zusätzlich Ultraschall genutzt werden.
Membrantechnik
Zunehmend werden auch Membranen zur Entfernung von Mikroorganismen benutzt. Mit Mikro- und Ultrafiltration lassen sich bei einer Porengröße von kleiner als 0,2 µm auch Bakterien, teilweise sogar Viren ausfiltern. (siehe auch Wasserfilter in der Haustechnik).
Gesetzlich vorgeschriebene Entnahme von Proben
In Deutschland gilt seit dem 1. November 2011 eine neue Trinkwasserverordnung. Sie schreibt vor, dass in nicht vom Eigentümer genutzten Wohnungen bzw. Häusern, die einen Warmwasserspeicher (Boiler) von mehr als 400 Litern Inhalt haben oder die Warmwasserleitungen mit mehr als drei Liter Inhalt zwischen dem Trinkwassererwärmer und der Entnahmestelle haben, einmal jährlich Wasserproben entnommen und untersucht werden müssen.[6]
Epidemiologie
Die Legionärskrankheit befällt als schwere Form der Lungenentzündung vor allem starke Raucher sowie Menschen, die an Niereninsuffizienz oder Immunsuppression leiden. Obwohl die Infektion in jedem Alter erfolgen kann, tritt die Erkrankung bevorzugt im mittleren Lebensalter auf. Männer erkranken zwei- bis dreimal so häufig wie Frauen.
Die Übertragung geschieht dabei nicht über Kontaktpersonen, sondern durch Einatmung der Legionellen. Da sich die Legionellen bevorzugt in warmem Wasser (18–50 °C, Maximum bei 36–43°C) vermehren, bergen insbesondere Schwimmbecken, Whirlpools, Klimaanlagen und Duschen ein erhöhtes Infektionsrisiko. Bei der Infektion werden zerstäubte Wassertröpfchen zusammen mit den Legionellen eingeatmet (aerogener Übertragungsweg); auch eine unabsichtliche Einatmung von geschlucktem Wasser (Aspiration) ist möglich. In der Folge ist vor allem im Sommer epidemisches Auftreten möglich, aber auch in der restlichen Zeit sind Infektionen wie jene 1999 in Stede Broec (Holland) nicht ausgeschlossen.
In Deutschland werden ca. 400 Fälle der Legionärskrankheit pro Jahr gemeldet. Von den bekannt gewordenen Krankheitsfällen mit Legionella-Pneumonie endete die Erkrankung bei vorher gesunden Menschen in etwa 15 % der Fälle tödlich, bei Menschen mit Immunschwäche und vorbestehenden Herz-/Lungenerkrankungen in bis zu 71 %. Bei der milden Verlaufsform des Pontiac-Fiebers ohne Lungenentzündung sind bisher keine Todesfälle bekannt.
Erreger und Pathogenese
Der Erreger, der diese Erkrankung auslöst, ist ein im Süßwasser vorkommendes, stäbchenförmiges Bakterium und wird nach dem betroffenen Organ, der Lunge, Legionella pneumophila (pneuma Atem, phil liebend) genannt.
In stehendem Wasser in haustechnischen Installationen (vor allem Klimaanlagen und wenig benutzten Wasserleitungen) mit Temperaturen zwischen 20 und 45 °C bestehen ideale Voraussetzungen für die Vermehrung des Erregers. Die Infektion erfolgt durch Einatmen von zerstäubtem Wasser, beispielsweise unter der Dusche oder aus einem Luftbefeuchter. Eine Übertragung von Mensch zu Mensch ist bisher nicht bekannt geworden und gilt als unwahrscheinlich. Der Erreger ist insbesondere für Menschen mit geschwächtem Immunsystem gefährlich und befällt die Lungenbläschen (Alveolen).
Die Legionellen überleben in der Regel Temperaturen nicht, die dauerhaft über 60 °C oder kurzzeitig über 70 °C liegen. Durch vorübergehende Aufheizung des Wassers auf 70 °C und aerosolarme Duschköpfe wird bei Neuinstallationen in Westeuropa der Infektionsgefahr entgegengewirkt.
Auf Reisen in Gebiete mit geringem Hygienestandard empfiehlt es sich, bei Bezug eines Hotelzimmers heißes Leitungswasser (Dusche/Waschbecken) für etwa 10 Minuten durchlaufen zu lassen. In dieser Zeit sollte man sich allerdings nicht in der Nähe aufhalten, um das Aerosol nicht einzuatmen.
Der Krankheitsverlauf wird durch virulenzassoziierte Epitope bestimmt.
Klinisches Erscheinungsbild
Legionärskrankheit
Nach einer Inkubationszeit von 2 bis 10 Tagen kommt es bei der Legionärskrankheit zu einem relativ raschen Krankheitsbeginn, meist aus völligem Wohlbefinden heraus. Die Symptome, mit der sich die Erkrankung präsentiert, sind unspezifisch und sehr variabel. Bei den meisten Patienten beginnt die Erkrankung mit relativ hohem Fieber und Schüttelfrost (nicht selten werden Körpertemperaturen von über 40 °C erreicht), mit Muskelschmerzen (Myalgien), die vor allem im Bereich des Brustkorbs lokalisiert sind (Thoraxschmerz) sowie mit anfangs trockenem Reizhusten, der nach einigen Tagen in Husten mit mäßigem Auswurf übergehen kann. Der Auswurf kann blutig tingiert sein (Hämoptysen) und in Kombination mit Thoraxschmerzen leicht zur Fehldiagnose einer Lungenembolie führen. Darüber hinaus kann es zu Atemnot, Kopfschmerzen, Übelkeit und Erbrechen, Durchfällen sowie vielfältigen neurologischen Ausfallerscheinungen kommen.
Die Letalität bei vorher gesundem Personenkreis beträgt bei dieser Verlaufsform etwa 15 %. Bei Menschen mit Immunschwäche oder vorbestehenden Herz- und Lungenerkrankungen beträgt die Letalität bis 70 % (aufgrund des Alters damit auch bei den Mitgliedern des Veteranentreffens, die der Krankheit den Namen gaben).
Pontiac-Fieber
Der milde Krankheitsverlauf mit Legionella wird als Pontiac-Fieber bezeichnet. Benannt ist es nach dem Ort der ersten dokumentierten Epidemie, der Stadt Pontiac im US-Bundesstaat Michigan. Dabei treten leichte, grippeähnliche Symptome ohne Lungenentzündung auf. Bisher führte das Pontiac-Fieber in keinem bekannten Fall zum Tod.
In Deutschland besitzen etwa 1 % der Bevölkerung Antikörper gegen Legionellen, diese bleiben ein Jahr im Körper. Legionellen kommen natürlicherweise weltweit im Süßwasser vor, entscheidend für den krankmachenden Faktor ist die Menge der Erreger. Die ist im normalen Umgebungswasser zu gering, aber unter günstigen Bedingungen können sich die Erreger explosionsartig vermehren, beispielsweise in Klimaanlagen. Daraus folgt, dass man mit 800.000 Menschen pro Jahr rechnen muss, die Kontakt mit dem Erreger hatten. Davon verläuft die Mehrzahl ohne Krankheitserscheinungen. Manifest wird die Erkrankung nur in 10 % der Fälle (etwa 80.000), nur etwa 9.600 sind davon „echte“ Legionellosen, das heißt Legionella-bedingte Pneumonien (12 %), beim Rest verläuft die Erkrankung mit grippeähnlichen milden Symptomen. Bei einer Letalität von 15–20 % bei vorher gesunden Menschen ist daher mit 1.400 bis 1.900 Todesfällen pro Jahr zu rechnen. Allerdings ist zu beachten, dass, wie oben erwähnt, für schon kranke und geschwächte Menschen die Erkrankung an Legionella-Pneumonie in bis zu 70 % tödlich endet. Legionella verursacht etwa 1–10 % aller Pneumonien und gehört damit zu deren häufigsten Ursachen.
Therapie
Eine Legionellose muss antibiotisch behandelt werden, da die Erkrankung lebensbedrohlich sein kann. Lange Zeit galt Erythromycin, z. B. in einer Dosierung von 3×1 g i. v. täglich als Antibiotikum der ersten Wahl. Weitere bei Legionellose wirksame Antibiotika sind die Makrolide Azithromycin, Clarithromycin, Roxithromycin und Breitspektrum-Fluorchinolone (z. B. Ciprofloxacin, Levofloxacin). Auch Rifampicin und Tetracycline wie Doxycyclin und Tigecyclin sind wirksam, gelten aber nicht als Mittel der ersten Wahl.[7][8]
Meldepflicht
In der Bundesrepublik Deutschland ist nach § 7 Infektionsschutzgesetz der direkte oder indirekte Nachweis einer akuten Infektion durch Legionella sp. durch das diagnostizierende Labor meldepflichtig. Seit 2001 werden meldepflichtige Erkrankungen vom Robert Koch-Institut erfasst, das für das Jahr 2004 insgesamt 475 gemeldete Legionellosen angab. Zur Meldung angehalten ist der Leiter der Untersuchungsstelle, in der der Nachweis geführt wurde. Noch ist eine Verpflichtung nicht eindeutig bestimmt. Auf jeden Fall ratsam ist die Meldung, wenn zwei Personen mit möglichem Kontakt zur gleichen Quelle eine Legionellen-Infektion aufweisen.
Literatur
- Stout JE et al.: Legionellosis. N Engl J Med. 1997 Sep 4;337(10):682–7. PMID 9278466
- Pedro-Botet ML et al.: Epidemiology and pathogenesis of Legionella infection. UpToDate v15.3, 2007
- Pedro-Botet ML et al.: Clinical manifestations and diagnosis of Legionella infection. UpToDate v15.3, 2007
- Pedro-Botet ML et al.: Treatment and prevention of Legionella infection. UpToDate v15.3, 2007
- Classen, Diehl, Kochsiek: Innere Medizin. Urban & Fischer, München 2006, 5. Auflage, S. 989–991. ISBN 3-437-44405-0
- W. Köhler et al.: Medizinische Mikrobiologie. Urban & Fischer, München/Jena 2001, 8. Auflage, S. 354–355. ISBN 3-437-41640-5
- Flemming, Hans Curt et al.: Erkenntnisse aus dem BMBF-Verbundprojekt „Biofilme in der Trinkwasser-Installation“, Version 2.1 (PDF-Datei; 0,5 MB ).
Einzelnachweise
- ↑ Screening von Legionellen im Trinkwasser , Laborwelt Nr. 2/2005, abgerufen am 26. September 2009
- ↑ I. W. Müller u. a.: Die Chronik der Medizin. Chronik-Verlag 1993, S. 560. ISBN 3-611-00273-9
- ↑ Smeeks FC et al.: Legionnaires Disease. Emedicine , 10. Oktober 2006 Online Version
- ↑ Heinz Röttlich: Maßnahmen gegen Legionellen im Wasser. In: Umwelt-Magazin. Heft 1/2 2010, Springer-VDI-Verlag, Düsseldorf 2010
- ↑ Bundesgesundheitsministerium
- ↑ Änderung der Trinkwasserverordnung
- ↑ Pedro-Botet ML, Yu VL: Treatment strategies for Legionella infection. Expert Opin Pharmacother. 2009;10(7):1109-21. PMID 19405787
- ↑ Diederen BMW: Legionella spp. and Legionnaires' disease. J Infect. 2008;56(1):1–12. PMID 17980914
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Intravenös
Der Begriff intravenös (Abk. i. v., von lat. intra „hinein“, „innen“, „innerhalb“ und vena „Vene“, „Blutader“; selten auch endovenös, von griech. ἔνδον „innen“) bedeutet „in einer Vene“ oder „in eine Vene hinein“. Man versteht darunter z. B. die direkte Verabreichung eines Medikaments oder einer Flüssigkeit oder Suspension in ein venöses Blutgefäß. Sie ist eine Form der parenteralen Gabe von Medikamenten, also eine Applikationsform. Die gegebene Flüssigkeit wird mit dem Blutstrom zum Herzen geführt und von dort aus über die Arterien im gesamten Organismus verteilt. Praktisch geschieht dies durch eine Injektion, Infusion oder Transfusion. Auch für die Blutentnahme aus einer Vene wird zunächst eine Nadel intravenös platziert.
Geschichte
Im 17. Jahrhundert wurde die intravenöse Injektion als neues Verfahren für die Verabreichung von Arzneimitteln zum ersten Mal beschrieben. Erste Berichte über die Injektion von Substanzen in Venen, durchgeführt zu experimentellen und nicht-therapeutischen Zwecken, sind vom berühmten Architekten Christopher Wren (1632-1723) überliefert. Er injizierte im Jahre 1656 Wein und Bier in die Venen eines Hundes. Diese Experimente wurden von Robert Boyle und Robert Hooke, die ebenfalls Hunden Opium und Safran injizierten und die Ergebnisse beobachteten.
Die Einführung der intravenösen Injektion beim Menschen und ihrer späteren Anwendung zur medizinischen Behandlung ist in erster Linie den Ärzten Johann Daniel Major (1634-1693), der 1664 in seinem Chirurgia Infusorien auf die Methode hinwies, und Johann Sigismund Elsholtz (1623-1688), der in seiner Schrift Clysmatica Nova, (1665 in deutscher Sprache) über seine entsprechenden Experimente an Leichen und Lebewesen berichtete. Mit diesen Arbeiten konnte die Effektivität der neuen Technik gezeigt werden und sie breitete sich rasch weiter aus.
Weiterentwicklung der Technik
Im Jahre 1843 gelang es George Bernard, Tieren Zuckerlösungen zu verabreichen. Aber erst im späten neunzehnten Jahrhundert und beginnenden zwanzigsten Jahrhundert konnte die intravenöse Therapie auf der Grundlage der Erkenntnisse in Mikrobiologie und Hygiene entscheidend weiterentwickelt werden. 1853 verwendete Alexander Wood als erster eine Subkutannadel zur intravenösen Verabreichung von Medikamenten. Wirklich populär wurde die Methode allerdings erst durch den französischen Arzt Charles Gabriel Pravaz (1791-1855), der einen Vorläufer der Injektionsspritze entwickelte. Im Jahre 1870 beschrieb Pierre Cyprien Ore die Verwendung von Chloralhydrat zur intravenösen Analgesie während Operationen und begründete damit die Technik der intravenösen Verabreichung von Medikamenten. Die erste intravenöse Verabreichung von Glukose an einen Menschen im Jahr 1896 durch Kraus Bield stellt einen Meilenstein in der Geschichte der intravenösen/parenteralen Ernährung dar.
Verfeinerung und allgemeine Anwendung
Die Einführung von Thiopental im Jahre 1930 ermöglichte durch dessen intravenöse Verabreichung eine sehr effektive, neue Methode der Narkoseeinleitung. Die gute Handhabbarkeit des kurzwirksamen Barbiturats Thiopental führte schnell zu der Überlegung, dass es genauso gut für Einleitung als auch Aufrechterhaltung der Narkose verwendet werden könnte. 1944 zeigte Pico wie intravenöses Thiopental in 1% Lösung mittels kontinuierlicher intravenöser Infusion verwendet werden konnte.
Während des Zweiten Weltkrieges erkannte man die Unzulänglichkeit der für die parenterale Ernährung entwickelten Glukose/Aminosäuren-Lösungen zur Behandlung von Verletzten. Dieses Problem konnte nur dann gelöst werden, wenn entweder das Volumen oder die Konzentration der Infusion erhöht würden. Dies war jedoch nicht möglich, da die verwendeten Venen nur kleinen Kalibers waren.
Im Jahre 1952 wurde die Punktion großkalibriger Venen beschrieben. Diese Technik, von Aubaniac zur Behandlung Kriegsverletzter entwickelt, erlaubte die Verwendung von Lösungen mit höheren Konzentrationen an Glukose und Aminosäuren. Im Jahre 1959 beschrieb Francis Daniels Moore die Verwendung der oberen Hohlvene zur Infusion von hochkonzentrierter Glukose.
Häufig genutzte Venen
Man unterscheidet periphervenöse Zugänge und zentralvenöse Zugänge (ZVK).
Als Venen zur intravenösen Behandlung werden beim Menschen meist die Armvenen (Vena mediana cubiti oder Vena cephalica) oder größere Venen am Hals (Vena jugularis interna) oder in der Leiste benutzt. Beim Säugling haben sich oberflächliche Schädelvenen bewährt.
Bei größeren Tieren (ab etwa Größe Schaf) wird zumeist die Drosselvene (Vena jugularis externa) genutzt. Bei Hunden und Katzen verwendet man meist eine Vorderbeinvene (Vena cephalica) oder Hinterbeinvene (Vena saphena lateralis). Beim Schwein und Kaninchen wird zumeist eine der Ohrvenen (Venae auriculares) genutzt. Bei sehr kleinen Heimtieren ist eine intravenöse Injektion fast unmöglich, hier wird bei Tierversuchen (in Narkose) die Drosselvene freipräpariert. Eine andere Methode, die in Tierkliniken bei kleinen Heimtieren, Vögeln, aber auch Hunde- und Katzenwelpen eingesetzt wird, ist die intraossäre Applikation (in einen Knochen), bei der aber ein absolut steriles Vorgehen essentiell ist, um Infektionen zu vermeiden.
Man kann sich die Punktion einer Vene durch einige Maßnahmen erleichtern:
- ausreichende Stauung
- ausführliches Tasten und Beklopfen der Vene
- Wärme (z. B. ein Armbad) erweitert die Venen (Kälte macht die Venen enger)
- Man kann die Venen gut im Ultraschall lokalisieren
- Kopftieflage bei Punktion der Vena jugularis externa oder interna am Hals
Praktische Vorgehensweise
Bei der intravenösen Punktion wird meist zum Herzen hin eingestochen. Die Stichrichtung ist aus praktischer Sicht unbedeutsam und ergibt sich nur aus der anatomischen Lage. Eine Verletzung der Venenklappen durch eine Nadel hat keine merkbaren Folgen.
Das intravenös verabreichte Volumen sollte den Flüssigkeitsbedarf des Patienten nicht übersteigen. Die Wirkung eines intravenös verabreichten Medikamentes tritt meistens innerhalb von Sekunden und ohne Resorptionsverlust ein. Ein Nachteil ist, dass das Aufsuchen einer Vene nicht immer ganz einfach ist. Auch der schnelle Eintritt der Wirkung ist nicht immer erwünscht.
Vorteile
Der große Vorteil von einer intravenösen Medikamentengabe ist, dass sich das Medikament sofort und im vollen Umfang im Blutkreislauf befindet. Bei geschluckten Medikamenten hingegen muss das Arzneimittel in chemischer Hinsicht so gestaltet sein, dass es nicht von der Salzsäure im Magen sowie von der Leber abgebaut wird (Stoffe aus dem Magen-Darm-Trakt passieren via Pfortader zuerst die Leber (first-pass effect); dazu passiert ein Teil des Medikaments gar nicht die Darmwand. Intravenös dargebotene Mittel können daher niedriger dosiert werden, um die gleiche Wirkung zu erzielen - und verursachen deshalb weniger Nebenwirkungen.
Risiken
Bei der intravenösen Punktion können Keime in die Blutbahn eingebracht werden, so dass nur mit sterilen Nadeln gearbeitet werden darf. Bei der längeren intravenösen Therapie über einen Venenverweilkatheter kommt es meist innerhalb einiger Tage zu einer Keimbesiedlung, so dass eine Thrombophlebitis, eine Bakteriämie und/oder eine Sepsis auftreten können. Um dies zu verhindern, wird der Verweilkatheter bei Beschwerden des Patienten umgehend entfernt.
Bei einem Durchstechen der Vene kann das Medikament paravenös, also in das umliegende Gewebe gelangen (Paravasat). Bei gewebsreizenden Medikamenten kann das zu einem örtlichen Absterben des Gewebes (Nekrose) oder zu Abszessen führen.
Des Weiteren besteht die Gefahr der Bildung von Hämatomen, der sekundären Perforation der Vene, der Venenschädigung und Venenreizung und der arteriellen Punktion und Injektion.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Sedierung - Sedativa
(Weitergeleitet von Sedativa)
Der Begriff Sedierung (seltener auch Sedation, von lat. sedare „beruhigen“), der in der Medizin – insbesondere in der Intensivmedizin oder bei der Anwendung von Psychopharmaka – verwendet wird, bezeichnet die Dämpfung von Funktionen des zentralen Nervensystems durch ein Beruhigungsmittel (Sedativum, auch Sedativ); zur selben Arzneigruppe gehören die Tranquilizer. Wird gleichzeitig ein Schmerzmittel (Analgetikum) verabreicht, spricht man von einer Analgosedierung. Der Übergang von einer Sedierung zu einer Allgemeinanästhesie (Narkose) ist fließend, bei letzterer ist der Patient nicht mehr erweckbar. Der vor allem in den Medien genutzte Begriff „Künstliches Koma“ ist nicht korrekt, denn dieses ist primär ein ungeregelter Bewusstseinsverlust.
In der Palliativmedizin wird die sogenannte terminale Sedierung eingesetzt.
Anwendung
Unruhe ist ein häufig anzutreffendes Symptom körperlicher wie psychischer Störungen oder Erkrankungen. Unruhezustände können durch die gezielte Gabe von Sedativa gelindert werden. Sedativa sind im Allgemeinen schlaffördernd und bewirken in höherer Dosierung eine Ausschaltung der bewussten Wahrnehmung, damit im Idealfall eine Distanzierung von verschiedenen Ängsten. Eine gezielte Behandlung der Angst wird demgegenüber als Anxiolyse bezeichnet.
Vor größeren diagnostischen oder therapeutischen Eingriffen ist eine Sedierung angezeigt, um die Stressbelastung für den Patienten zu reduzieren und dessen Ansprechbarkeit dennoch zu gewährleisten und so die bestmögliche Zusammenarbeit mit dem Untersucher oder Behandler zu ermöglichen. Um die Risiken für mögliche Komplikationen wie einen unbeabsichtigten Bewusstseinsverlust, ein Ausschalten oder die Beeinträchtigung der Schutzreflexe (wie den Hustenreflex) oder eine Kreislauf- oder Atemdepression zu minimieren, sind geeignete Vorsichtsmaßnahmen zum Schutz des Patienten zu treffen.[1]
Ist eine tiefere Sedierung notwendig oder muss mit einem Übergang in eine Narkose gerechnet werden, bedarf der Patient einer entsprechenden intensiven Überwachung und Unterstützung, sodass ein Anästhesist hinzugezogen werden muss, der neben dem geeigneten Sedativum häufig bei Bedarf noch ein Analgetikum verabreicht. Eine überwachte Sedierung mit Analgesie wird als "Analgosedierung" bezeichnet.[2]
Im Rahmen der Intensivmedizin wird bei beatmeten Patienten die Verabreichung von Sedativa zumeist nötig, da eine Beatmung, insbesondere beim nichttracheotomierten Patienten, ohne solche Medikamente häufig nicht toleriert wird. Die gewünschte Sedierungstiefe wird je nach Situation vom Arzt anhand der Richmond Agitation Sedation Scale (früher der Ramsay-Skala) festgelegt, regelmäßig kontrolliert und bei Bedarf angepasst. Man geht nach den von der DGAI erstellten Leitlinien vor.[3]
Ein großes Problem ist das regelmäßige Sedieren von Menschen in Alten- und Pflegeheimen, um diese „ruhigzustellen“, wobei häufig missachtet wird, dass es sich bei der Sedierung im juristischen Sinn um eine Form der Fixierung handelt. Diese erfordert das Einverständnis des Patienten oder, bei fehlender Einwilligungsfähigkeit, die ärztliche Anordnung nebst richterlicher Genehmigung oder Anordnung (§ 1906 IV BGB). Siehe hierzu: Pflegeskandal.
Substanzen
- Benzodiazepine wie Diazepam, Midazolam, Temazepam, Nitrazepam, Flunitrazepam
- Narkotika wie Propofol. Barbiturate wie Phenobarbital werden in heutiger Zeit kaum noch als Beruhigungsmittel eingesetzt; sie dienen vielmehr als Antiepileptika.
- Neuroleptika wie Promethazin
- Opioide wie Fentanyl, Morphin und Sufentanil
- Heute werden vermehrt Alpha-2-Adrenozeptor-Agonisten eingesetzt, etwa Clonidin
- Valnoctamid
Probleme
Viele Sedativa führen zur Toleranz (Gewöhnung), so dass es im Verlauf der Anwendung zur Dosissteigerung oder zur Verwendung eines anderen Sedativums kommen muss, um die gewünschte Sedierungstiefe aufrechtzuerhalten. Viele Sedativa haben deshalb ein Missbrauchspotential in der Daueranwendung (gilt nicht für Neuroleptika), das bis zur Sucht führen kann.
Der oben beschriebene Vorteil von Sedativa, die Ausschaltung des Bewusstseins, kann andererseits einen Nachteil darstellen. Ist die Dosis zu hoch, kommt es zur Reduzierung des Atemantriebs, so dass der Patient unter Umständen sogar beatmet werden muss.
Ferner gibt es paradoxe Reaktionen: Das Arzneimittel erreicht nicht die erwünschte Wirkung, der Patient wird unruhig und nicht mehr führbar.
Quellen
- ↑ AWMF online; Leitlinien der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin – Sedierung und Analgesie (Analgosedierung) von Patienten durch Nicht-Anästhesisten
- ↑ Leitlinien der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) und der Deutschen Interdisziplinären Vereinigung für Intensiv- und Notfallmedizin (DIVI): Analgesie, Sedierung und Delirmanagement in der Intensivmedizin - Langfassung
- ↑ S3-Leitlinie Analgesie, Sedierung und Delirmanagement in der Intensivmedizin der DGAI und DIVI. In: AWMF online (Stand 12/2009)
Literatur
- Analgesie und Sedierung in der Intensivmedizin. Mitglieder der Arbeitsgruppe „S2-Leitlinien Analgesie und Sedierung in der Intensivmedizin“ der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) und des Berufsverbandes Deutscher Anästhesisten (BDA). Anästh Intensivmed 2005;46; Supplement Nr. 1/2005;S1-20
- Continuum of depth of sedation, definition of general anesthesia, and levels of sedation/analgesia. American Society of Anesthesiologists Standards, Guidelines, and Statements, October 27, 2004. (PDF, 68 KB)
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Psychopharmakon - Psychopharmaka
(Weitergeleitet von Psychopharmaka)
Ein Psychopharmakon (von griech. ψυχή „Seele“ und φάρμακον „Arzneimittel“; Mehrzahl: Psychopharmaka) ist ein Arzneistoff (vgl. Medikament), der auf die Psyche des Menschen symptomatisch einwirkt und vorwiegend der Behandlung psychischer Störungen und neurologischer Krankheiten dient. Hierbei kommt es oftmals zu einer Phasenverkürzung, nicht jedoch zur Heilung chronischer psychischer Erkrankungen. Einige Psychopharmaka werden auch als Narkosemittel oder zur Behandlung von Symptomen organischer Krankheiten eingesetzt. Nach einer Statistik der Betriebskrankenkassen aus dem Jahr 2009 hat sich die Zahl der Verordnungen von Psychopharmaka in drei Jahren verdoppelt.[1]
Bei psychischen Störungen sind neben der medikamentösen Behandlung weitere Interventionen, zumindest begleitende Gespräche, wichtig. Häufig werden sowohl Psychopharmaka als auch Psychotherapie in Kombination eingesetzt.
Wirkungsmechanismus
Einigen psychischen Erkrankungen liegen Störungen des Neurotransmitterhaushalts (insbesondere Dysbalancen der Monoamine Dopamin, Noradrenalin und Serotonin) und – teils als deren Ursache, teils als deren Folge – neurophysiologische Veränderungen zugrunde (wie z. B. von der Dichte und der Sensibilität von Rezeptoren, sowie von intrazellulären Strukturen). Einige Psychopharmaka zielen darauf ab, den gestörten Neurotransmitterhaushalt auszugleichen, andere richten sich mehr auf die Neujustierung physiologischer Effektorstrukturen.
Einteilung
- Antidepressiva
- Neuroleptika
- Tranquillanzien
- Phasenprophylaktika (z. B. Lithium)
- Psychostimulantien
- Halluzinogene
Rechtliches
Im Abschlussbericht der Bund-Länder Arbeitsgruppe „Betreuungsrecht“[2] zur 74. Konferenz der Justizministerinnen und -minister im Juni 2003 werden ab Seite 159 Psychopharmaka benannt, die wegen stark schädigenen Nebenwirkungen (Parkinsonoid und Spätdyskinesien) bei Behandlung von Betreuten als durch das Vormundschaftsgericht genehmigungsbedürftig eingestuft werden. Diskutiert wird besonders potente Psychopharmaka wie Clozapin und Lithium, die Langzeitbehandlung mit Neuroleptika und Antikonvulsiva, z. B. Benperidol, Promethazin und Levomepromazin, wegen der damit verbundenen Gefahr von Spätfolgen durch eine Liste ins Gesetz aufzunehmen, „um die bedenkenlose (unkontrollierte) Anwendung einzudämmen“.
Laut einer neuen Studie der Universität Witten/Herdecke verordnen Psychiater und Neurologen Patienten in Pflegeheimen bezogen auf Menge und Dosierung doppelt bis viermal so viele Psychopharmaka wie Allgemeinmediziner.[3]
Literatur
Einführungen
- Benkert, Hippius: "Kompendium der Psychiatrischen Pharmakotherapie", Springer-Verlag, Berlin 2010, ISBN 978-3-642-13043-4
- Greve, Osterfeld, Diekmann: Umgang mit Psychopharmaka - Ein Patienten-Ratgeber, BALANCE buch+medien verlag, Bonn 2007, ISBN 978-3-86739-002-6
- Finzen, Asmus: Medikamentenbehandlung bei psychischen Störungen - Einführung in die Therapie mit Psychopharmaka. Psychiatrie-Verlag, Bonn 2004, (14. Aufl.). ISBN 3-88414-372-7
- Burkhardt-Neumann, Carola: Wegweiser Psychopharmaka. Wirkstoffe für die Seele, ZENIT Verlag, München 2005, ISBN 978-3-928316-23-1
Unerwünschte Wirkungen
- F. L. Tornatore, J. J. Sramek, B. L. Okeya, E. H. Pi: Unerwünschte Wirkungen von Psychopharmaka, Georg Thieme Verlag, Stuttgart, New York 1991, ISBN 3-13-754601-X
Geschichte
- Bangen, Hans, Geschichte der medikamentösen Therapie der Schizophrenie, Berlin 1992. ISBN 3-927408-82-4
- Hall, Frank, Psychopharmaka - ihre Entwicklung und klinische Erprobung: zur Geschichte der deutschen Pharmakopsychiatrie von 1844 - 1952, Hamburg: Kovac, 1997
- Healy, David, The Antidepressant Era, Harvard University Press, 3. Auflage 2000
- Laux, Gerd: Fünfzig Jahre Psychopharmaka, AVP 2008:(35)6:110-112
Versorgungsforschung
- Johannes Pantel, Gisela Bockenheimer-Lucius, Ingwer Ebsen, Ruth Müller, Peter Hustedt und Alexander Diehm: Psychopharmakaversorgung im Altenpflegeheim: eine interdisziplinäre Studie unter Berücksichtigung medizinischer, ethischer und juristischer Aspekte. Frankfurt am Main, Lang. 2006. Reihe: Frankfurter Schriften zur Gesundheitspolitik und zum Gesundheitsrecht. ISBN 3-631-55095-2.
- H.-U. Melchert: Einnahme von Psychopharmaka in: Die Gesundheit der Deutschen - Ein Ost-West-Vergleich von Gesundheitsdaten, Hrsg. H. Hoffmeister , B. Bellach, RKI-Hefte 7/95, Robert Koch-Institut, Berlin 1995, ISBN 3-89606-008-2
Nachschlagewerke für Synonyme, INN und systematische Stoffnamen
- Walter Pöldinger, François Wider: Index Psychopharmacorum (Englisch - Deutsch - Französisch - Italienisch - Spanisch), Hans Huber Verlag 1990, Bern/Stuttgart/Toronto, ISBN 3-456-81770-3
Einzelnachweise
- ↑ sueddeutsche.de: Arbeit in Zeiten der Wirtschaftskrise − Angst ist unproduktiv . 6. Januar 2009.
- ↑ Abschlussbericht der Bund-Länder Arbeitsgruppe „Betreuungsrecht“
- ↑ Der Hausarzt, 10/2010, S. 21
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Benzodiazepine
Benzodiazepine sind bicyclische, das heißt aus zwei ringförmigen Grundkörpern bestehende, organische Verbindungen. Einige Vertreter der Gruppe finden in der Medizin Verwendung als angstlösende, zentral muskelrelaxierende, sedierend und hypnotisch (schlaffördernd) wirkende Arzneistoffe, sogenannte Tranquilizer.[1] Manche Benzodiazepine zeigen auch antikonvulsive Eigenschaften und dienen als Antiepileptika. Alle Benzodiazepine binden an GABA-Rezeptoren, die wichtigsten inhibitorischen Rezeptoren im zentralen Nervensystem.
Struktur
Benzodiazepine bestehen aus einem siebengliedrigen ungesättigten Ring, der zwei Stickstoffatome beinhaltet und somit zu den heterocyclischen Verbindungen gehört. Gemäß der Hantzsch-Widman-Nomenklatur für heterocyclische Systeme wird dieser Ring als Diazepinring bezeichnet.[2] Im Falle der Benzodiazepine ist an den Diazepinring noch ein Benzolring anelliert.
Als Arzneistoffe kommen nahezu nur 1H-Benzo-1,4-diazepine zum Einsatz, die in 5-Position einen weiteren sechsgliedrigen Ring wie Benzol, Pyridin oder Cyclohexen tragen.[3] Der einzig verwendete Vertreter der 1H-Benzo-1,5-diazepine ist das Clobazam.[1]
Geschichte
Die erste Verbindung aus dieser Gruppe, die zum Einsatz kam, war Chlordiazepoxid.[1] Es wurde von Leo Sternbach für Hoffmann-La Roche entwickelt und 1960 unter dem Handelsnamen Librium® auf den Markt gebracht. Im weiteren Verlauf der Forschung sind vor allem Verbindungen mit Lactamstruktur eingeführt worden, so das ebenfalls von Leo Sternbach entwickelte Diazepam, das 1963 unter dem Handelsnamen Valium® durch Hoffmann-La Roche auf den Markt gebracht wurde. 1977 wurde Diazepam in die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgenommen. In Deutschland war Diazepam noch 2005 das am häufigsten verordnete Benzodiazepin.[4]
Wirkungsmechanismus
Benzodiazepine vermitteln ihre Wirkung dadurch, dass sie modulierend auf die Bindungsstelle des Neurotransmitters GABA (γ-Aminobuttersäure) am GABAA-Rezeptor, einem Chlorid-Ionenkanal, wirken. Dadurch wird die Wirksamkeit des inhibitorisch wirkenden Neurotransmitters GABA verstärkt, was zur Folge hat, dass die Öffnungswahrscheinlichkeit des Chlorid-Kanals erhöht wird und sich somit der Einstrom der Chlorid-Ionen in die Nervenzelle erhöht, was wiederum zu einer geringeren Erregbarkeit der Neuronenmembran führt (durch Hyperpolarisation und Kurzschluss von EPSPs).[1]
Benzodiazepine unterscheiden sich in ihrer Wirkung von Barbituraten.[5] Dafür sind folgende Mechanismen verantwortlich:
- Benzodiazepine wirken nur zusammen mit GABA und sind allein nicht in der Lage, den GABAA-Rezeptor zu öffnen. Streng genommen müsste man sie daher eher als Synergisten bezeichnen anstatt als Agonisten.[3]
- Benzodiazepine wirken an Synapsen, die wenig GABA enthalten, stärker als an solchen, die viel GABA enthalten.
- Schwache Transmitter-Antworten werden mehr verstärkt als starke Transmitter-Antworten. Man spricht von einer aktivitätsabhängigen Wirkung (engl.: use dependence). Dieser Effekt könnte auch verantwortlich sein für eine relativ spezifische Wirkung der Benzodiazepine (anxiolytisch, antikonvulsiv, zentral muskelrelaxierend, sedativ/hypnotisch, amnestisch s. u.), trotz der ubiquitären Verteilung der GABA-Rezeptoren im Gehirn und Rückenmark.
Auch hohe Dosen von Benzodiazepinen verstärken die Maximalwirkung (die theoretisch auch durch GABA allein erreicht werden könnte) nicht. Sie setzen lediglich die GABA-Dosis herab, die zu einer Maximalwirkung führt. Pharmakologisch ausgedrückt führen sie zu einer Linksverschiebung der Dosis-Wirkungs-Kurve.
Wirkungen und Nebenwirkungen
Benzodiazepine wirken
- anxiolytisch (angstlösend)
- antikonvulsiv (krampflösend)
- muskelrelaxierend (muskelentspannend)
- sedativ (beruhigend)
- hypnotisch (schlaffördernd)
- amnestisch (Erinnerung für die Zeit der Wirkdauer fehlt)
- leicht stimmungsaufhellend (jedoch kann eine depressive Grunderkrankung möglicherweise verstärkt werden)
- teils euphorisierend (je nach Dosierung und Einnahmeintervall).[6]
Sie finden in der Psychiatrie Anwendung bei der Behandlung von Angst- und Unruhezuständen, als Notfallmedikation bei epileptischen Krampfanfällen und als Ein- und Durchschlafmittel. Ferner werden sie als Prämedikation vor Operationen verordnet, damit der Patient entspannt und angstfrei ist.[7]
Während im Tierversuch bereits nach einer Woche kontinuierlicher Gabe von Höchstdosen ein Entzugssyndrom ausgelöst werden kann, ist dies beim Menschen in therapeutischen Dosierungen wohl erst nach mindestens 8 Wochen Expositionsdauer möglich.[8] In der Regel wird empfohlen, eine Einnahmedauer von 4 Wochen[9] nicht zu überschreiten, um die Gefahr einer Abhängigkeitsentwicklung zu minimieren. Zusammenfassend muss die Indikation zur Verordnung von Benzodiazepinen somit kritisch gestellt werden und die Anwendung so kurz wie möglich und die Dosis so gering wie möglich gehalten werden. Bei einer Dauerbehandlung sind die Gefahren gegen den therapeutischen Nutzen sorgfältig abzuwägen. Die meisten Benzodiazepine sind grundsätzlich nicht zur Dauerbehandlung zugelassen. Ausnahmen bilden die antiepileptisch wirksamen Benzodiazepine, welche bei entsprechender Indikationsstellung nicht selten lebenslang eingenommen werden müssen. Das Alprazolam-haltige Medikament Tafil® (D) nimmt eine Sonderstellung ein, da es als einziges in Deutschland zugelassenes Benzodiazepin-Präparat – im Unterschied zu allen sonstigen zugelassenen benzodiazepinhaltigen Medikamenten – auch zur Langzeitbehandlung von Panikstörungen (bis zu 12 Wochen) zugelassen ist.
Benzodiazepinpräparate sind dosisabhängig und je nach Substanz unterschiedlich stark atemdepressiv, d. h. sie dämpfen das Atemzentrum. Lebensbedrohliche Intoxikationen sind bei alleiniger BZD-Einnahme selten, allerdings potenziert sich das Risiko bei gleichzeitigem Alkoholkonsum oder bei gleichzeitiger Gabe anderer ZNS-wirksamer Präparate, hier besonders zu erwähnen die Opioide, da diese selbst stark atemdepressiv wirken. Außerdem wird bei gleichzeitiger Einnahmen von Opioiden und Benzodiazepinen deren Wirkung und damit auch Suchtpotential gegenseitig verstärkt. Benzodiazepine beeinträchtigen die Reaktionszeit. Zumindest während der ersten Tage einer Einnahme von benzodiazepinhaltigen Arzneimitteln besteht Fahruntüchtigkeit. Im Verlaufe einer fortgesetzten Therapie entscheidet der behandelnde Arzt von Fall zu Fall, ob das Führen eines Kraftfahrzeuges oder das Bedienen gefährlicher Maschinen wieder möglich ist.[10]
Benzodiazepine gelten weltweit als die Medikamente mit der höchsten Missbrauchsrate.[11]
Es gibt klare Hinweise für Risiken des menschlichen Fetus in Verbindung mit Benzodiazepin-Verabreichung während der Schwangerschaft. Im Tierversuch gab es zudem Hinweise auf Verhaltensstörungen der Nachkommen, wenn den Muttertieren während der Schwangerschaft Benzodiazepine verabreicht wurden.[12]
Kontraindikationen
Kontraindikationen bei der Anwendung von Benzodiazepinen[13]:
- Myasthenia gravis
- Ataxie, Engwinkelglaukom
- Bekannter Alkohol-, Drogen oder Medikamentenmissbrauch – auch in der Vorgeschichte
- Allergie gegen Benzodiazepine
Einzelstoffe
|
 |
|
|
|
Wirkstoff
|
Wirkungstyp
|
chemische Bezeichnung
|
Halbwertszeit (Metaboliten-HWZ)
|
Jahr der Markteinführung
|
|
Alprazolam
|
Tranquilizer, Anxiolytikum
|
8-Chlor-1-methyl-6-phenyl- 4H-[1,2,4]-triazolo[4,3-a][1,4]benzodiazepin
|
12–15 h
|
1984
|
|
Bentazepam
|
Tranquilizer, Anxiolytikum
|
5-Phenyl-1,2,3,4,7,9-hexahydro-10-thia-6,9-diazabenzo[a]azulen-8-on
|
2,8 - 4,5 h
|
|
|
Bromazepam
|
Tranquilizer, Anxiolytikum
|
7-Brom-2,3-dihydro-5-(2-pyridyl)- 1H-1,4-benzodiazepin-2-on
|
15–28 h
|
1977
|
|
Brotizolam
|
Hypnotikum, Sedativum
|
2-Brom-4-(2-chlorphenyl)-9-methyl- 6H-thieno[3,2-f][1,2,4]triazolo[4,3-a][1,4]diazepin
|
3–6 h (4–19 h)
|
|
|
Chlordiazepoxid
|
Tranquilizer
|
7-Chlor-2-methylamino-5-phenyl- 3H-1,4-benzodiazepin-4-oxid
|
5–30 h (48–96 h)
|
1960
|
|
Clobazam
|
Tranquilizer, Anxiolytikum, Antiepileptikum
|
7-Chlor-1-methyl-5-phenyl- 1H-1,5-benzodiazepin-2,4(3H,5H)-dion
|
18 h (36–80–120 h)
|
|
|
Clonazepam
|
Antiepileptikum
|
5-(2-Chlorphenyl)-2,3-dihydro-7-nitro- 1H-1,4-benzodiazepin-2-on
|
30–40 h
|
|
|
Diazepam
|
Tranquilizer, Antiepileptikum
|
7-Chlor-2,3-dihydro-1-methyl-5-phenyl- 1H-1,4-benzodiazepin-2-on
|
24–48 h (50–80 h)
|
1963
|
|
Clorazepat
|
Tranquilizer
|
7-Chlor-2,3-dihydro-2,2-dihydroxy-5-phenyl- 1H-1,4-benzodiazepin-3-carbonsäure
|
(25–82 h)
|
|
|
Flunitrazepam
|
Hypnotikum
|
5-(2-Fluorphenyl)-2,3-dihydro-1-methyl-7-nitro- 1H-1,4-benzodiazepin-2-on
|
16–35h
|
1975
|
|
Flurazepam
|
Hypnotikum
|
7-Chlor-1-(2-diethylaminoethyl)-5-(2-fluorphenyl)-2,3-dihydro- 1H-1,4-benzodiazepin-2-on
|
1,5 h (1 h oder 50–100 h)
|
|
|
Loprazolam
|
Tranquilizer
|
6-(2-Chlorphenyl)-2,4-dihydro-2-[(4-methyl-1-piperazinyl)methylen]-8-nitro- 1H-imidazo[1,2-a][1,4]benzodiazepin-1-on
|
8–9 h
|
|
|
Lorazepam
|
Tranquilizer, Antiepileptikum
|
(RS)-7-Chlor-5-(2-chlorphenyl)-2,3-dihydro-3-hydroxy- 1H-1,4-benzodiazepin-2-on
|
12,9–16,2 h
|
1963
|
|
Lormetazepam
|
Hypnotikum
|
(RS)-7-Chlor-5-(2-chlorphenyl)-2,3-dihydro-3-hydroxy-1-methyl- 1H-1,4-benzodiazepin-2-on
|
10–14 h
|
|
|
Medazepam
|
Tranquilizer
|
7-Chlor-2,3-dihydro-1-methyl-5-phenyl- 1H-1,4-benzodiazepin
|
2–5 h (50–80 h)
|
|
|
Midazolam
|
Kurzhypnotikum
|
8-Chlor-6-(2-fluorphenyl)-1-methyl- 4H-imidazo[1,5a][1,4]benzodiazepin
|
1,5–2,5 h
|
1976
|
|
Nitrazepam
|
Hypnotikum
|
2,3-Dihydro-7-nitro-5-phenyl- 1H-1,4-benzodiazepin-2-on
|
18–30 h
|
|
|
Nordazepam
|
Tranquilizer
|
7-Chlor-2,3-dihydro-5-phenyl- 1H-1,4-benzodiazepin-2-on
|
50–90 h (8 h)
|
|
|
Oxazepam
|
Tranquilizer
|
(RS)-7-Chlor-2,3-dihydro-3-hydroxy-5-phenyl- 1H-1,4-benzodiazepin-2-on
|
5–15 h
|
1965
|
|
Phenazepam
|
Tranquilizer
|
7-Brom-5-(2-chlorphenyl)-1,3-dihydro-1,4-benzodiazepin-2-on
|
(60 h)
|
|
|
Prazepam
|
Tranquilizer
|
7-Chlor-1-(cyclopropylmethyl)-2,3-dihydro-5-phenyl- 1H-1,4-benzodiazepin-2-on
|
(50–90 h)
|
|
|
Temazepam
|
Hypnotikum
|
(RS)-7-Chlor-3-hydroxy-1-methyl-5-phenyl- 1H-1,4-benzodiazepin-2(3H)-on
|
5–13 h
|
|
|
Tetrazepam
|
Myotonolytikum (Muskelrelaxans)
|
7-Chlor-5-(1-cyclohexenyl)-1-methyl- 1H-1,4-benzodiazepin-2(3H)-on
|
18 h
|
|
|
Triazolam
|
Hypnotikum
|
8-Chlor-6-(2-chlorphenyl)-1-methyl- 4H-1,2,4-triazolo[4,3-a][1,4]benzodiazepin
|
1,4–4,6 h
|
|
|
 |
 |
|
Gegenmittel
Flumazenil, ein reversibler kompetitiver Antagonist, hebt nach einer intravenösen Gabe die Wirkung von Benzodiazepinpräparaten zumindest kurzfristig wieder auf (HWZ etwa 45 min). Es ist aber unbedingt auf ein Nachgeben von Flumazenil zu achten, da die HWZ von Flumazenil unter jener der Benzodiazepinen liegt, und die Antagonistenwirkung durch die Esterspaltung rasch inaktiviert wird.
Rechtslage in Deutschland
Nahezu alle Vertreter aus der Wirkstoffgruppe der Benzodiazepine unterliegen in der Bundesrepublik Deutschland der Gesetzgebung des Betäubungsmittelgesetzes (BtMG). Einige Benzodiazepine werden durch das Gesetz allerdings nicht erfasst, dazu gehören Phenazepam und Bentazepam (Handelsname: Tiadipona). Nicht regulierte Benzodiazepine unterliegen als in Deutschland bzw. in der EU nicht zugelassenes Importarzneimittel gemäß §73 AMG der Rezeptpflicht.
Die meisten Benzodiazepine sind in die Anlage III (verkehrsfähige und verschreibungsfähige Betäubungsmittel) zum BtMG aufgenommen worden. Der Gesetzgeber hat hierbei Höchstmengen pro abgeteilter Form (Tablette, Suppositorium, Ampulle, Volumeneinheit bei Tropfen) und/oder Höchstmengen pro Packung festgelegt, unterhalb deren die Betäubungsmittel-Verschreibungs-Verordnung nicht gilt („ausgenommene Zubereitungen“). Diese Höchstmengen sind für jeden einzelnen Wirkstoff einzeln festgelegt (z.B. 10 mg pro abgeteilter Tabletten-Einheit für Diazepam). Die Höchstmengen ergeben sich aus der Anlage III zum BtMG.
Seit dem 1. November 2011 unterliegt das Benzodiazepin Flunitrazepam ausnahmslos den Verschreibungsvorschriften der BtMVV. Es ist daher seit Anfang November 2011 nicht mehr auf gewöhnlichem Kassenrezept verschreibbar, sondern nur noch auf einem BtM-Rezept.[14]
Verordnungspraxis in Deutschland
Die Verordnung von Benzodiazepinen in Deutschland ging von 228 Millionen definierten Tagestherapiedosen (DDD) im Jahr 1995 auf 68 Millionen DDD im Jahr 2004 zurück.[15]
Allerdings hat die Anzahl der Verordnungen auf Privatrezepten zugenommen, gemäß der Deutschen Gesellschaft für Psychiatrie, Psychotherapie und Psychotherapie (DGPPN):
„ Die Verordnung von Benzodiazepinen zulasten der Gesetzlichen Krankenkassen (GKV) ging von 11 Mio. (1993) auf 2,5 Mio. Packungen (2004) zurück, während laut Einkaufsstatistik die Abgabe durch Apotheken nur von 12,7 Mio. auf 5,6 Mio. Packungen zurückging. Z-Drugs (Zaleplon, Zopiclon, Zolpidem) nahmen in der GKV von 2,1 Mio.(1993) auf 3,8 Mio. Packungen (2004) zu, die Abgabe durch Apotheken laut Einkaufsstatistik aber wesentlich ausgeprägter von 2,2 Mio. auf 7,4 Mio. Packungen. Dies interpretieren die Autoren Hoffmann, Glaeske, Scharffetter[16] wohl zutreffend als vermehrte Verordnung auf Privatrezept. Die Datenbasis erlaubt nicht den Versicherungsstatus (GKV/PKV) der Patienten festzustellen, Es erscheint aber plausibel anzunehmen, dass die steigende Zahl von Verordnungen von Benzodiazepinhypnotika auf Privatrezept auch GKV-Versicherten gilt. Letztendlich basieren die Empfehlungen der AkdÄ auf der Vermutung, dass die Verordnung von Benzodiazepinhypnotika auf Privatrezept bei Kassenpatienten auf einen Missbrauch dieser Substanzgruppe hinweise, der durch eine solche Verordnungsweise weniger transparent und nachvollziehbar gemacht werden solle.“
– Stellungnahme der Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde -DGPPN- zu den „Empfehlungen der Arzneimittelkommission der deutschen Ärzteschaft zur Verordnung von benzodiazepinhaltigen Hypnotika“ vom 11. September 2008 Online (abgerufen am 17. Januar 2012)
Einzelnachweise
- ↑ a b c d Wissenschaft-Online-Lexika: Eintrag zu Benzodiazepine im Lexikon der Neurologie, abgerufen am 28. Mai 2009
- ↑ D. Hellwinkel: Die systematische Nomenklatur der Organischen Chemie, 4. Auflage, Springer Verlag, Berlin, 1998, ISBN 3-540-63221-2.
- ↑ a b American Psychiatric Association: Task Force on Benzodiazepine Dependency: Benzodiazepine dependence, toxicity, and abuse: a task force report of the American Psychiatric Association. American Psychiatric Pub, 1990, ISBN 978-0-89042-228-1
- ↑ ePsy.de Psychopharmaka in der Praxis 2005
- ↑ Hans Walter Striebel: Die Anästhesie: Grundlagen und Praxis. Schattauer Verlag, 2003, ISBN 978-3-7945-1985-9, S. 36–37
- ↑ Claus-Jürgen Estler, Harald Schmidt: Pharmakologie und Toxikologie. 6. Auflage, Schattauer Verlag, 2007, ISBN 978-3-7945-2295-8, S. 201–206
- ↑ Reinhard Larsen: Anästhesie. 8. Auflage, Elsevier,Urban&FischerVerlag, 2006, ISBN 978-3-437-22501-7, S. 442
- ↑ AWMF online: Medikamentenabhängigkeit
- ↑ Christopher L Sola and Co-Authors: Sedative, Hypnotic, Anxiolytic Use Disorders; Medscape, 2010
- ↑ R. Braun, F. von Bruchhausen, Hermann Hager, Hubert Schneemann, Gisela Wurm: Hagers Handbuch der pharmazeutischen Praxis, Band 1: Waren und Dienste. 5. Auflage, 1995, ISBN 978-3-540-58958-7, S. 474-477
- ↑ The Ashton Manual: Benzodiazepines: How they work and how to withdraw: http://www.xxx
- ↑ Fachinformation des Arzneimittel-Kompendium der Schweiz für Dormicum® Ampullen. Stand der Informationen: November 2009
- ↑ Otto Benkert,Hanns Hippius; Kompendium der psychiatrischen Pharmakotherapie, S.335; ISBN 978-3540784708
- ↑ http://www.xxx
- ↑ Deutsche Hauptstelle für Suchtfragen (Hg.) (2006): Möglichkeiten und Defizite in der Erreichbarkeit ausgewählter Zielgruppen (sozial benachteiligte Frauen und ältere Menschen) durch Maßnahmen und Materialien zur Reduzierung von Medikamentenmissbrauch und -abhängigkeit: Bewertung anhand aktueller Forschungsergebnisse und Beispielen aus der Praxis.
- ↑ F. Hoffmann, G. Glaeske, W. Scharffetter: Zunehmender Hypnotikaverbrauch auf Privatrezepten in Deutschland. SUCHT 52. Jahrgang 2006, Heft Nr. 6, Seiten 360–366
Literatur
- Harald Schütz: Benzodiazepines A Handbook, Springer-Verlag, Berlin - Heidelberg - New York, 1982, ISBN 3-540-11270-7
- Harald Schütz: Benzodiazepines II A Handbook, Springer-Verlag, Berlin - Heidelberg - New York, 1989, ISBN 3-540-50249-1
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Anästhetikum - Narkotika
(Weitergeleitet von Narkotika)
Als Anästhetika (Einzahl Anästhetikum) bezeichnet man Medikamente, die zur Erzeugung einer Anästhesie (Zustand der Empfindungslosigkeit zum Zweck einer operativen oder diagnostischen Maßnahme) dienen.
Systematik
Je nachdem, ob die Wirkstoffe auf den ganzen Organismus oder nur einen Teil desselben einwirken, werden zwei Gruppen von Anästhetika unterschieden.[1]
- Setzt das Arzneimittel die Schmerzempfindung örtlich begrenzt herab, spricht man von einem Lokalanästhetikum. Sie werden im Rahmen einer Lokalanästhesie (bzw. Regionalanästhesie) eingesetzt, also einer örtlichen Schmerzausschaltung im Bereich von Nervenendigungen oder Leitungsbahnen, ohne das Bewusstsein zu beeinträchtigen.
- Von einem Allgemeinanästhetikum oder Narkotikum wird bei Mitteln gesprochen, die eine Allgemeinanästhesie oder umgangssprachlich eine Narkose erzeugen, also eine Schmerz- und Bewusstseinsausschaltung im zentralen Nervensystem bewirken, aus der der Patient nicht erweckbar ist. Die Allgemeinanästhesie setzt sich aus einer sensorischen (Blockade der Schmerzempfindung), mentalen (Blockade von Bewusstsein und Erinnerungsvermögen), motorischen (Blockade der motorischen Reaktion) und reflektorischen Komponente (Hemmung von vegetativen Reaktionen) zusammen. Diese werden von verschiedenen Wirkstoffen in verschiedenem Ausmaß bewirkt. Als Untergruppen werden nach dem Weg der Verabreichung intravenöse Anästhetika, die in eine Vene injiziert werden, von Inhalationsanästhetika unterschieden, die mit der Atemluft zugeführt werden. Im Allgemeinen werden zu den intravenösen Anästhetika Schlafmittel (Hypnotika) wie Propofol, Etomidat und Barbiturate, (selten GHB), Sedativa wie Benzodiazepine, Schmerzmittel (Analgetika) wie Opioide und Ketamin und manchmal im weiteren Sinne auch die Muskelrelaxantien gezählt.
Der Begriff Betäubungsmittel umfasst eine ähnliche Stoffgruppe, ist aber als Rechtsbegriff aus dem deutschen Betäubungsmittelgesetz (BtMG) nicht deckungsgleich.
Wirktheorien
Obwohl sich auch die heute verwendeten Anästhetika gemäß der Meyer-Overton-Korrelation beschreiben lassen, lassen sich Theorien über die Wirkmechanismen von Anästhetika, die auf ihr beruhen (Einfluss auf die Lipidbestandteile des zentralen Nervensystems), nicht mehr aufrechterhalten. Die Vorstellung eines einheitlichen Mechanismus (Unitaritäts-Prinzip) von Anästhetika wird heute als veraltet angesehen und vom Konzept der multiplen Wirkmechanismen und Wirkorte abgelöst. Wirkungen auf eine Reihe von (Protein-basierten) Rezeptoren und Ionenkanälen (Opioid-Rezeptor, GABAA-Rezeptor, NMDA-Rezeptor, Natrium- und Kalium-Kanäle) und andere Modifikation der synaptischen Signalübertragung in verschiedenen Bereichen des zentralen Nervensystems, die für einzelne Anästhetika in unterschiedlichem Ausmaß existieren, werden nach heutigem Wissensstand für die verschiedenen Dimensionen einer Narkose verantwortlich gemacht. Eine umfassende Narkosetheorie, die sich aus den bekannten Mechanismen erklären lässt, liegt jedoch nicht vor, sodass eine Wirkung gemäß der Meyer-Overton-Hypothese letztlich nicht ausgeschlossen werden kann und zum Teil auch kontrovers diskutiert wird.[2]
Einzelnachweise
- ↑ H. A. Adams, E. Kochs, C. Krier: Heutige Anästhesieverfahren – Versuch einer Systematik. Anästhesiol Intensivmed Notfallmed Schmerzther 2001; 36: 262-267. PMID 11413694
- ↑ Franks NP: Molecular targets underlying general anaesthesia. Br J Pharmacol. 2006 Jan;147 Suppl 1:S72-81. Review. PMID 16402123
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Neuroleptikum - Neuroleptika
(Weitergeleitet von Neuroleptika)
Als Neuroleptikum (etwa „Nervendämpfungsmittel“) oder Antipsychotikum wird ein Medikament bezeichnet, das als psychotrope Substanz eine antipsychotische, sedierende und psychomotorische Wirkung besitzt und vor allem zur Behandlung von Psychosen eingesetzt wird. Darüber hinaus werden hochpotente Neuroleptika (wie z. B. Droperidol) zusammen mit einem Opioid-Analgetikum (Fentanyl) zur Neuroleptanalgesie, einer Sonderform der Analgesie, verwendet.[1] Der Begriff Neuroleptika wurde 1955 eingeführt, seit den 1990er Jahren werden diese Medikamente häufig auch Antipsychotika genannt.
Der Einsatz von neuroleptischen Medikamenten ist heute üblicher Standard bei der Behandlung von akuten Psychosen, wobei nicht jede akute Psychose mit Neuroleptika behandelt wird (siehe Antidepressiva). Eine dauerhafte Medikation, nach Möglichkeit in geringerer Dosierung als in der Akutphase, kann erneuten Phasen akuter psychotischer Störungen vorbeugen.
Mit Einführung der Neuroleptikamedikation Anfang der fünfziger Jahre des zwanzigsten Jahrhunderts ist der Anteil an im Krankenhaus behandelten Menschen mit psychotischen Symptomen aus dem schizophrenen Formenkreis signifikant gesunken.
Chemie
Trizyklische Neuroleptika (Phenothiazine und Thioxanthene)
Seit den 1950er-Jahren finden die trizyklischen Neuroleptika therapeutische Anwendung. Sie besitzen ein trizyklisches Phenothiazin- (Phenothiazine: zum Beispiel Chlorpromazin, Fluphenazin, Levomepromazin, Prothipendyl, Perazin, Promazin, Thioridazin und Triflupromazin) oder Thioxanthenringsystem (Thioxanthene: zum Beispiel Chlorprothixen und Flupentixol). Das trizyklische Promethazin war zudem das erste therapeutisch genutzte Antihistaminikum. Strukturell ähneln trizyklische Neuroleptika weitgehend den trizyklischen Antidepressiva. Unterschiede in der pharmakologischen Wirkung zwischen beiden Substanzklassen werden mit einer voneinander abweichenden dreidimensionalen Konformation des trizyklischen Ringsystems in Verbindung gebracht.
Dibenzepine
Von den älteren trizyklischen Neuroleptika sind die neueren trizyklischen Dibenzepine (zum Beispiel Clozapin, Olanzapin, Quetiapin und Zotepin) abzugrenzen. Sie verfügen über ein Dibenzothiepin- (Zotepin), Dibenzodiazepin- (Clozapin), Thienobenzodiazepin- (Olanzapin) oder ein Dibenzothiazepin-Ringsystem (Quetiapin), welche eine von den klassischen trizyklischen Neuroleptika abweichende dreidimensionale Anordnung besitzen und somit für deren abweichende (atypische) pharmakologische Wirkung verantwortlich sind.
Butyrophenone und Diphenylbutylpiperidine
Die Butyrophenone (z. B. Haloperidol, Melperon, Bromperidol und Pipamperon) zeichnen sich chemisch durch einen 1-Phenyl-1-butanon-Baustein aus. Ausgehend vom Haloperidol wurden zahlreiche weitere Neuroleptika entwickelt, etwa das Spiperon mit klar erkennbarer Strukturverwandtschaft zu den Butyrophenonen. Therapeutische Anwendung finden auch die abgeleiteten Diphenylbutylpiperidine Fluspirilen und Pimozid).
Benzamide
Eine Sonderstellung nehmen die Benzamide (Wirkstoffe Sulpirid und Amisulprid) ein, die außer einem neuroleptischen noch einen gewissen stimmungsaufhellenden, aktivierenden Effekt haben.
Benzisoxazol-Derivate, andere Stoffe
Zwischen den „Atypika“ Risperidon und Ziprasidon bestehen ebenfalls Strukturparallelen, sie können als entfernt mit Haloperidol verwandt betrachtet werden. Das neuere Aripiprazol weist einige Gemeinsamkeiten mit den älteren Substanzen auf. Während Risperidon besonders stark antipsychotisch wirkt, zeigt Ziprasidon noch einen Noradrenalin-spezifischen Effekt. Aripiprazol ist ein Partialagonist an Dopamin-Rezeptoren und in diesem Punkt von sämtlichen übrigen Neuroleptika verschieden.
Alkaloide
Das pentazyklische Rauvolfia-Alkaloid Reserpin hat in der Therapie der Schizophrenie nur noch historische Bedeutung.
Pharmakologie
Neuroleptische Potenz
Nach Einführung der Neuroleptika hatte man festgestellt, dass ein Medikament umso stärker antipsychotisch wirkte, je größer seine extrapyramidal-motorischen Nebenwirkungen waren. Man führte daher den Begriff der neuroleptischen Potenz ein, der ein Maß für diese Nebenwirkungen ist. Erst mit der Einführung des Clozapin im Jahre 1971 kamen Medikamente auf den Markt, bei denen dieser Zusammenhang nicht besteht und die als atypische Neuroleptika bezeichnet werden. Die neuroleptische Potenz wird im Chlorpromazin-Index (CPZi) angegeben.
CPZ-Äquivalent: 1 mg der Substanz entspricht x mg Chlorpromazin.
Zum Beispiel: Chlorpromazin als Standardwirkstoff hat einen CPZi = 1, Haloperidol CPZi = 50, Perphenazin CPZi = 10; dies heißt, dass 1 mg Haloperidol eine neuroleptische Potenz vergleichbar mit 50 mg Chlorpromazin und Perphenazin 1 mg mit 10 mg Chlorpromazin besitzen.
Je nach der Potenz werden klassische Neuroleptika in drei Klassen unterteilt:
- niederpotente Neuroleptika (CPZi ≤ 1,0)
Beispiele: Promethazin, Levomepromazin, Thioridazin, Promazin
- mittelpotente Neuroleptika (CPZi = 1,0-10,0)
Beispiele: Chlorpromazin, Perazin, Zuclopenthixol
- hochpotente Neuroleptika (CPZi > 10,0)
Beispiele: Perphenazin, Fluphenazin, Haloperidol, Benperidol
Die Zahlenangabe der Potenz eines Neuroleptikums sagt wenig über den Effekt der Substanz im Einzelfall (beim konkreten Patienten) aus, da individuell das Ansprechen auf eine Dosis sehr verschieden sein kann.
|
 |
|
|
|
Neuroleptikum (Arzneistoff)
|
Stoffklasse
|
CPZ- Äquivalent X
|
mittlere (-max.) Dosis je Tag in mg
|
|
Hochpotente N.:
|
|
|
|
|
Benperidol
|
Butyrophenon
|
75
|
1,5–20 (–40)
|
|
Haloperidol
|
Butyrophenon
|
50
|
1,5–20 (–100)
|
|
Bromperidol
|
Butyrophenon
|
50
|
5–20 (–50)
|
|
Flupentixol
|
Thioxanthen
|
50
|
3–20 (–60)
|
|
Fluspirilen
|
DPBP
|
50
|
1,5–10 mg/Wo. (max.)
|
|
Olanzapin
|
Thienobenzodiazepin
|
50
|
5–20 (max.)
|
|
Pimozid
|
DPBP
|
50
|
1–4 (–16)
|
|
Risperidon
|
Benzisoxazolderivat
|
50
|
2–8 (–16)
|
|
Fluphenazin
|
Phenothiazin
|
40
|
2,5–20 (–40)
|
|
Trifluoperazin
|
Phenothiazin
|
25
|
1–6 (–20)
|
|
Perphenazin
|
Phenothiazin
|
15
|
4–24 (–48)
|
|
Mittelpotente N.:
|
|
|
|
|
Zuclopenthixol
|
Thioxanthen
|
5
|
20–40 (–80)
|
|
Clopenthixol
|
Thioxanthen
|
2,5
|
25–150 (–300)
|
|
Chlorpromazin
|
Phenothiazin
|
1
|
25–400 (–800)
|
|
Clozapin
|
Dibenzodiazepin
|
1
|
12,5–450 (–900)
|
|
Melperon
|
Butyrophenon
|
1
|
25–300 (–600)
|
|
Perazin
|
Phenothiazin
|
1
|
75–600 (–800)
|
|
Quetiapin
|
Dibenzothiazepin
|
1
|
150–750 (max.)
|
|
Thioridazin
|
Phenothiazin
|
1
|
25–300 (–600)
|
|
Niedrigpotente N.:
|
|
|
|
|
Pipamperon
|
Butyrophenon
|
0,8
|
40–360 (max.)
|
|
Triflupromazin
|
Phenothiazin
|
0,8
|
10–150 (–600)
|
|
Chlorprothixen
|
Thioxanthen
|
0,8
|
100–420 (–800)
|
|
Prothipendyl
|
Azaphenothiazin
|
0,7
|
40–320 (max.)
|
|
Levomepromazin
|
Phenothiazin
|
0,5
|
25–300 (–600)
|
|
Promazin
|
Phenothiazin
|
0,5
|
25–150 (–1.000)
|
|
Promethazin
|
Phenothiazin
|
0,5
|
50–300 (–1.200)
|
|
Amisulprid
|
Benzamid
|
0,2
|
50–1.200 (max.)
|
|
Sulpirid
|
Benzamid
|
0,2
|
200–1.600 (–3.200)
|
|
(Modifiziert nach Möller 2001, S. 243)
|
|
|
|
|
 |
 |
|
Wirkmechanismus
Als gesichert gilt heute, dass der Wirkungsmechanismus von Neuroleptika auf einem Eingreifen in die synaptische Erregungsübertragung innerhalb des Gehirns beruht, wobei alle derzeitigen Neuroleptika die Übertragung des Neurotransmitters Dopamin hemmen. Zusätzlich können Neuroleptika mit Rezeptoren für Serotonin, Acetylcholin, Histamin und Noradrenalin interagieren.
Neuroleptika wirken symptomatisch, das heißt, sie können psychische Krankheiten nicht im eigentlichen Sinne heilen, aber Symptome wie Halluzinationen oder Wahn können damit zumeist beseitigt werden. Dies ermöglicht dem Patienten eine Distanzierung von der Erkrankung - er kann also seinen Zustand selbst als krankhaft erkennen.
Neuroleptika beeinflussen nicht das Bewusstsein und die intellektuellen Fähigkeiten, können jedoch mitunter stark sedieren. Insbesondere atypische Neuroleptika führen häufig sogar zu einer besseren Konzentrationsfähigkeit und Sprachfähigkeiten. Teilweise haben Neuroleptika neben der antipsychotischen auch eine sedierende (beruhigende) Wirkung. Zumindest für die herkömmlichen Neuroleptika gilt dabei: je geringer die neuroleptische Potenz, desto stärker ist die Sedierung.
Typische Neuroleptika
Herkömmliche (typische) Neuroleptika sind antipsychotisch wirksame Arzneistoffe mit einer weitgehend einseitigen Wirkung auf die sogenannte Positiv-Symptomatik der Schizophrenie (zum Beispiel Halluzinationen, Wahnvorstellungen). Pharmakologisch sind sie Antagonisten des Dopamins am D2-Rezeptor. Zu den typischen Neuroleptika gehören (geordnet nach abnehmender neuroleptischer Potenz) u. a.:
- Haloperidol
- Flupentixol
- Fluspirilen
- Chlorprothixen
- Prothipendyl
- Levomepromazin
Atypische Neuroleptika
Als „atypisch“ werden Neuroleptika bezeichnet, die die typischen Nebenwirkungen der Neuroleptika seltener hervorrufen, insbesondere extrapyramidal-motorische Störungen (EPMS) und Spätdyskinesien.
Als atypische Neuroleptika gelten:
- Clozapin
- Olanzapin
- Quetiapin
- Risperidon
- Paliperidon
- Amisulprid
- Ziprasidon
- Aripiprazol
- Sulpirid
Unerwünschte Wirkungen
Die hier genannten unerwünschten Wirkungen treten nicht alle zwangsläufig und auch nicht in gleicher Weise bei allen Neuroleptika auf.
Bei den Nebenwirkungen sind solche vegetativer Art (hormonelle und sexuelle Störungen, Muskel- und Bewegungsstörungen, Schwangerschaftsschäden, Körpertemperaturstörungen etc.) und solche psychischer Art (sedierende Wirkungen, Depressionen, Antriebslosigkeit, emotionale Verarmung, Verwirrtheit, andere Wirkungen auf das Zentralnervensystem etc.) zu unterscheiden. Betroffene selbst beschreiben oft ein Gefühl, „eingemauert“ zu sein.
Eine Folge der hemmenden Wirkung der Neuroleptika auf den Überträgerstoff Dopamin ist die Störung der Steuerung von körperlichen Bewegungsabläufen, da Dopamin daran wesentlich beteiligt ist. Dabei wird unterschieden zwischen:
- Frühdyskinesien: Unwillkürliche Bewegungen bis hin zu krampfartigen Anspannungen von Muskeln und Muskelgruppen. Als quälend wird zum Beispiel das Zungenschlundphänomen mit Zungenkrämpfen und Schlundkrämpfen erlebt. Frühdyskinesien sind üblicherweise nach Absetzen eines Neuroleptikums bzw. Umstellung auf ein nebenwirkungsärmeres Präparat reversibel, bilden sich also zurück. Auch das Anticholinergikum Biperiden kann Frühdyskinesien aufheben.
- Während der Behandlung können als Nebenwirkung auch Bewegungsstörungen auftreten, die an die Parkinson-Krankheit erinnern und deswegen als Parkinsonoid bezeichnet werden. Auch dystone Störungen wie zum Beispiel ein Schiefhals kommen vor. Zur Früherkennung solcher Störungen kann der auf Handschriftenbeobachtung beruhende Haase-Schwellen-Test (HST) genutzt werden.
- Bei Langzeitbehandlungen treten in bis zu 20 % aller Fälle Spätdyskinesien, auch Tardive Dyskinesien genannt auf. Das sind Bewegungsstörungen im Gesichtsbereich (Zuckungen, Schmatz- und Kaubewegungen) oder Hyperkinesen (unwillkürliche Bewegungsabläufe) der Extremitäten. Diese treten nach längerer neuroleptischer Behandlung auf und scheinen eine Abhängigkeit von der insgesamt aufgenommenen Menge an Neuroleptika aufzuweisen. Spätdyskinesien werden zwar von den Betroffenen teilweise als weniger störend erlebt, fallen aber der Umwelt auf und sind dadurch oft bei der sozialen Reintegration störend. Spätdyskinesien sind häufig nicht reversibel und sprechen auch schlecht auf Biperiden an. Das Absetzen des Neuroleptikums verstärkt zumeist die Dyskinesie, ist aber die einzige Möglichkeit zur langdauernden Besserung. Dosisreduktion und Anticholinergika verschlechtern die Situation zumeist.
- Akathisie: Eine quälende Sitzunruhe, die die Patienten dazu bringt ständig umherzulaufen. Diese Nebenwirkung spricht auf Biperiden nur mäßig an. Sie tritt unter atypischen Neuroleptika seltener auf.
Die Spät-Dyskinesien treten bei unterschiedlichen Neuroleptika unterschiedlich häufig auf. Grundsätzlich ist bei herkömmlichen, hochpotenten (stark antipsychotisch wirkenden) Neuroleptika das Auftreten von Dyskinesien wahrscheinlicher. Neuere, so genannte atypische Neuroleptika, versuchen durch eine spezifische Rezeptorbindung die Gefahr einer Dyskinesie zu mindern. Dies gelingt teilweise und vor allem bei sparsamer Dosierung. Keine Dyskinesien verursacht Clozapin. Clozapin kann allerdings gefährliche Blutbildstörungen verursachen, weshalb regelmäßige Kontrollen (Leukozyten und Thrombozyten) erforderlich sind.
Weitere mögliche unerwünschte Wirkungen sind Sedierung (Müdigkeit, Verlangsamung der Reaktionen), Leber- oder Nierenfunktionsstörungen, Herzrhythmusstörungen, Funktionsstörung der Bauchspeicheldrüse, Einschränkungen von Sexualität und Libido, Gewichtszunahme, Hormonstörungen (u. a. bei Frauen: Störungen der Regelblutung). Fallkontrollstudien zeigten auch ein um etwa ein Drittel erhöhtes Risiko für eine Thromboembolie.[2]
Bei Vorliegen einer entsprechenden Disposition können Neuroleptika der Auslöser für sog. Gelegenheitsanfälle sein.
Seltene (bis zu 0,4 %), aber unter Umständen lebensgefährliche Nebenwirkungen sind das Maligne Neuroleptische Syndrom mit Fieber, Muskelsteifigkeit und Bewegungsstarre, Bewusstseinsstörungen, starkem Schwitzen und beschleunigter Atmung sowie Störungen der Bildung weißer Blutkörperchen (Agranulozytose).
Bestimmte Neuroleptika dürfen unter anderem nicht eingenommen werden bei einigen Blutbildveränderungen (z. B. Clozapin), Hirnerkrankungen, akuten Vergiftungen, bestimmten Herzerkrankungen sowie bei schweren Leber- und Nierenschäden. Die Einnahme von Neuroleptika zusammen mit Alkohol oder Beruhigungsmitteln kann zu einer gefährlichen Wirkungsverstärkung führen. Tee, Kaffee und andere koffeinhaltige Getränke können die Wirkung von Neuroleptika verringern. Durch Neuroleptika kann es zu einer Beeinträchtigung des Reaktionsvermögens kommen. Die Fahrtüchtigkeit kann eingeschränkt sein, und es kann zu einer Gefährdung am Arbeitsplatz (zum Beispiel beim Bedienen von Maschinen) kommen.
Die Behandlung mit Neuroleptika führt schließlich auch noch zu einem dosis- und zeitabhängigen Umbau der Struktur des Gehirns mit einer Verschiebung der Verhältnisses von Grauer zu Weisser Substanz und einer Verringerung des Volumens verschiedener seiner Strukturen[3]. Antipsychotika schränken auch Problemlösen [4] und Lernen [5] ein. Sie werden überdies mit der Entstehung von Hypophysentumoren in Verbindung gebracht [6] und können im Alter zu Stürzen führen.
Rechtsstatus
In Deutschland unterliegt die zwangsweise Verabreichung von Antipsychotika strengen Auflagen. Nach mehreren Urteilen des Bundesverfassungsgerichts ist es nur mehr in sehr eng gesteckten Grenzen möglich Neuroleptika gegen den Willen der Behandelten in geschlossenen Psychiatrien und dem Maßregelvollzugs zu verabreichen. Diese Auflagen sind Beispielsweise dann nicht erfüllt, wenn ein Patient gegen seinen Willen behandelt werden soll weil er seinen Behandlern misstraut und eine vertrauensbildende Psychotherapie keinen Erfolg zeigt.[7][8]
Quellen
- ↑ Fachinformation Droperidol® Sintetica des Arzneimittel-Kompendiums® der Schweiz
- ↑ C. Parker, C. Coupland, J. Hippisley-Cox: Antipsychotic drugs and risk of venous thromboembolism: nested case-control study. In: BMJ (British Medical Journal). 341, 2010, S. c4245. PMID 20858909 .
- ↑ Puri BK.: Brain tissue changes and antipsychotic medication.. In: Expert Rev Neurother.. 2011. PMID 21721911 .
- ↑ Wasserman JI, Barry RJ, Bradford L, Delva NJ, Beninger RJ.: Probabilistic classification and gambling in patients with schizophrenia receiving medication: comparison of risperidone, olanzapine, clozapine and typical antipsychotics.. In: Psychopharmacology (Berl).. 2012. PMID 22237855 .
- ↑ Harris MS, Wiseman CL, Reilly JL, Keshavan MS, Sweeney JA.: Effects of risperidone on procedural learning in antipsychotic-naive first-episode schizophrenia.. In: Neuropsychopharmacology... 2009. PMID 18536701 .
- ↑ Wasserman JI, Barry RJ, Bradford L, Delva NJ, Beninger RJ.: Atypical antipsychotics and pituitary tumors: a pharmacovigilance study.. In: Pharmacotherapy. 2006. PMID 16716128 .
- ↑ Urteil auf http://www.xx
- ↑ Urteil auf http://www.xxx
Literatur
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4.
- Möller u. a.: Psychopharmakotherapie. ISBN 3-17-014297-6.
- O. Benkert, H. Hippius: Psychiatrische Pharmakotherapie. Springer, ISBN 3-540-58149-9.
- Klaus Windgassen, Olaf Bick: Fortschritte in der neuroleptischen Schizophreniebehandlung: Neuroleptika der zweiten Generation.
- Barbara Dieckmann, Margret Osterfeld, Nils Greeve: Gewichtszunahme unter Neuroleptika. In: Psychosoziale Umschau. April
- 2004. Artikel über Gewichtszunahme durch Neuroleptika sowie deren Folgen und Risiken. PDF, 137 kB.
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Opioide
Opioide (von gr. ὄπιον [ˈɔpiɔn] und εἶδος, [ˈidɔs], „dem Opium ähnlich“) ist ein Sammelbegriff für eine chemisch heterogene (uneinheitliche) Gruppe natürlicher und synthetischer Substanzen, die morphinartige Eigenschaften aufweisen und an Opioidrezeptoren wirksam sind. Der Begriff Opiat bezeichnet hingegen nur die natürlicherweise im Opium vorkommenden Stoffe mit dieser Wirkung, die chemisch Alkaloide darstellen und aus der Milch des Schlafmohns (Papaver somniferum) gewonnen werden.
Man unterscheidet körpereigene (endogene) Opioide, die eine Rolle bei der Schmerzunterdrückung im Rahmen der Stressreaktion spielen, von therapeutisch oder missbräuchlich zugeführten (exogenen) Opioiden.
Das Wirkspektrum von Opioiden ist komplex und sehr unterschiedlich. Die wichtigste Wirkung ist eine starke Schmerzlinderung (Analgesie), was Opioide zu unverzichtbaren und vielgenutzten Arzneimitteln in der Schmerztherapie, Anästhesie und anderen Einsatzbereichen macht. Unter den vielfältigen weiteren Wirkungen sind Sedierung und der euphorisierende Effekt zu nennen; die die wichtigsten Nebenwirkungen sind und Vigilanzminderung und Atemdepression, v.a. bei Überdosierung, sowie bei längerer Einnahme Obstipation (Verstopfung) und Entwicklung einer Abhängigkeit - sofern Opioide nicht zur Therapie chronischer Schmerzen eingesetzt werden.[1][2]
In Deutschland und der Schweiz unterliegen sie deshalb dem Betäubungsmittel-, in Österreich dem Suchtmittelgesetz.
Wirkungsweise
Die Gruppe der Opioide ist eine chemisch heterogene Untergruppe der Analgetika. Sie entfalten ihre Eigenschaften durch Wechselwirkung mit speziellen Rezeptoren (molekularen Bindungs-Orten) auf der Oberfläche von Nervenzellen und von anderen Zellen im ganzen Körper, die Opioidrezeptoren genannt werden.
Die körpereigenen Liganden der Opioidrezeptoren sind endogene Peptide (Enkephaline und Endorphine), die in der Stressantwort von Bedeutung sind. Die Opioidrezeptoren kommen am häufigsten im Gehirn am Boden des vierten Ventrikels, in anderen Gehirnregionen und im Rückenmark vor. Sie sind zudem in der Peripherie, unter anderem im Darm zu finden.
Beispielhaft für ein Opioid mit Wirkung ausschließlich außerhalb des zentralen Nervensystems ist Loperamid, ein Mittel gegen Durchfall. Es überwindet die Blut-Hirn-Schranke normalerweise nicht und kann deshalb nicht im zentralen Nervensystem, sondern nur peripher im Körper wirken. Es bewirkt eine Verlangsamung der Darmperistaltik.
Opioide entfalten im Gegensatz zu den Nichtopioid-Analgetika ihre analgetische Wirkung vorrangig im Zentralnervensystem (ZNS).
Rezeptoren
Es werden mehrere unterschiedliche Typen und Subtypen der Opioidrezeptoren unterschieden
Opioidrezeptoren
|
 |
|
|
|
Typ
|
Lokalisation
|
Wirkung
|
|
μ1 und μ2
|
Gehirn
|
Analgesie, Atemdepression nur μ2!, Herz-Kreislauf-Wirkungen
|
|
μ2
|
spinal, supraspinal
|
Analgesie, Magen-Darm-Wirkung, Euphorie, Sucht
|
|
μ
|
peripher
|
Analgesie, Magen-Darm-Wirkung, Juckreiz
|
|
κ (Kappa)
|
Gehirn, spinal
|
Analgesie, Sedierung, Dysphorie
|
|
δ (Delta)
|
Gehirn, spinal, peripher
|
Magen-Darm-Wirkung, Modulierende Wirkung
|
|
bisher nicht identifizierter Rezeptor
|
|
Miosis, Übelkeit, Erbrechen
|
|
 |
 |
|
Agonisten und Antagonisten
Die Opioide binden gruppenspezifisch unterschiedlich stark an die verschiedenen Rezeptoren, wobei sie aktivierend (Agonisten) oder hemmend (Antagonisten) wirken können, wodurch ein komplexes Wirkmuster entsteht (multiple receptor theory). Es werden vier Gruppen unterschieden:
Reine Agonisten
Reine Agonisten haben eine ausschließlich aktivierende Wirkung mit einer hohen Affinität (Bindungsstärke) und hoher intrinsischer Aktivität (Wirkstärke) zu μ-Rezeptoren sowie geringerer Affinität zu κ-Rezeptoren. Meptazinol bindet selektiv am μ1-Rezeptor und vermindert so bei Fortbestehen der analgetischen Wirkung die μ2-vermittelte Atemdepression[3]. Die Wirkung dieser Stoffe lässt sich durch Antagonisten komplett aufheben. Die Kombination von reinen Agonisten mit gemischten Agonisten-Antagonisten ist nicht zweckmäßig, da dadurch die Wirkung abgeschwächt wird. Die meisten in der Medizin eingesetzten Opioid-Pharmaka sind reine Agonisten, Beispiele sind Tramadol, Pethidin, Codein, Piritramid, Morphin, Levomethadon sowie die starken Analgetika Fentanyl, Alfentanil, Remifentanil und Sufentanil.
Gemischte Agonisten-Antagonisten
Gemischte Agonisten-Antagonisten bieten ein komplexes Wirkmuster. An μ-Rezeptoren sind sie Liganden mit einer hohen Affinität, jedoch sehr schwachen intrinsischen Aktivität, sodass eine antagonistische Wirkung resultiert. An κ-Rezeptoren hingegen sind Affinität und intrinsische Aktivität hoch (κ-Agonisten). Auch an σ-Rezeptoren wirken sie agonistisch. Im Gegensatz zu den reinen Agonisten erfolgt mit steigender Dosierung keine weitere Zunahme der Wirkungen (Ceiling-Effekt). Substanzen dieser Gruppe sind Pentazocin, Butorphanol und Nalbuphin, wobei aufgrund der Neigung zu Dysphorie, Halluzinationen, Desorientierung sowie Kreislaufstimulation (σ-Agonisten) die pharmakologische Bedeutung stark zurückgegangen ist.
Partialagonisten
Die einzige pharmakologisch relevante Substanz ist das Buprenorphin, das an μ-Rezeptoren eine sehr hohe Affinität, eine etwa 30-mal stärkeren Aktivität und längere analgetische Wirkdauer (6-8h) als Morphin aufweist. Es unterliegt ebenfalls einem Ceiling-Effekt, wobei es nicht durch den Einsatz von Antagonisten beendet werden kann. Buprenorphin hat die längste Wirkdauer aller Opioide.
Reine Antagonisten
Reine Antagonisten wirken an allen Rezeptortypen als kompetitive Antagonisten, jedoch mit unterschiedlicher Affinität. Sie werden meist zur Aufhebung (Antagonisierung) von agonistischen Opioid-Wirkungen (Narkosebeendigung, Gegengift bei Intoxikation, Entwöhnungsbehandlung) eingesetzt. Eingesetzte Wirkstoffe sind Naloxon und Naltrexon.
Natürliche Opioide
Endogene Opioide
Die endogenen Opioide sind körpereigene Peptide, die im Rahmen der Stressantwort ausgeschüttet werden und zur akuten Schmerz- und Hungerunterdrückung dienen, jedoch auch mit den Sexualhormonen interagieren und an der Entstehung von Euphorie sowie der Regulation von gastrointestinaler Funktionen, Atmung, Thermoregulation und Immunreaktionen beteiligt sind. Sie werden bei Verletzungen, jedoch auch durch emotionale Stimuli und UV-Licht ausgeschüttet. Auch bei Übergewicht, psychischen Störungen, aber auch Opioidgabe ist ihre Sekretion verändert. Ein genaues Verständnis dieser komplexen Funktionen und Regulationsvorgänge fehlt bisher.
Die endogenen Opioide lassen sich in drei Gruppen einteilen. Das Vorläuferpeptid der Endorphine ist das Pro-Opiomelanocortine (POMC), woraus die Endorphine α, β und γ hervorgehen. Aus der Gruppe der Enkephaline sind die Varianten Met-Enkephalin, Leu-Enkephalin und Met-Arg-Phe-Enkephalin, die sich durch die N-terminalen Aminosäuren unterscheiden. Die Dynorphine unterteilen sich in Dynorphin A und B sowie α- und β-Neoendorphin.
Die endogenen Opioide (Neuropeptide) werden bei Säugetieren in Hypothalamus und Hypophyse produziert und unterscheiden sich in Verteilung und Rezeptoraffinität.[4]
Opiate / Opium-Alkaloide
Als Opiate werden natürliche Substanzen, die im Opium vorkommen, bezeichnet. Das Opium, das aus Schlafmohn (Papaver somniferum) gewonnen wird, besteht zu etwa 25 % aus diesen Alkaloiden. Die wichtigsten Stoffe sind Morphin (10 %), Codein (0,5 %) und Thebain (0,2 %) aus der Gruppe der Phenantrane sowie Noscapin (6 %), Papaverin (0,8-1 %) und Narcein (0,3 %), die Benzylisochinoline sind.[5]
Eckdaten gebräuchlicher Opioide
Übersicht über pharmakologische Daten[6][7][8] und betäubungsmittelrechtliche Regelung
|
 |
|
|
|
Name
|
relative Potenz
|
minimale Wirkdauer
|
Klassifikation
|
Anmerkungen
|
Betäubungsmittelrechtliche Einordnung (Deutschland)
|
|
Sufentanil
|
≈1000
|
30 min
|
Agonist
|
Stärkstes humanmedizinisches Analgetikum
|
verschreibungsfähiges Betäubungsmittel (BtM)
|
|
Remifentani
|
l≈100-200
|
8-10 min
|
Agonist
|
Sehr kurze Halbwertszeit, deshalb sehr gut steuerbar. Vor allem im Rahmen der TIVA eingesetzt.
|
verschreibungsfähiges BtM
|
|
Fentanyl
|
120
|
30 min
|
Agonist
|
Zur Neuroleptanalgesie geeignet
|
verschreibungsfähiges BtM
|
|
Alfentanil
|
30-40
|
10 min
|
Agonist
|
transdermal anwendbar
|
verschreibungsfähiges BtM
|
|
Buprenorphin
|
≈30
|
6-8 h
|
partieller Agonist
|
wirkt bei alleiniger Gabe schmerzstillend, in Kombination mit Agonisten antagonistisch; Ceiling-Effekt
|
verschreibungsfähiges BtM
|
|
Hydromorphon
|
7,5
|
3-5 h (unretardiert)
|
Agonistsedierende
|
Wirkung ist im Vergleich zu Morphins deutlich geringer
|
verschreibungsfähiges BtM
|
|
Levomethadon
|
4
|
5-7 h
|
Agonist
|
Kumulation und starke Halbwertszeiterhöhung bei täglicher Verabreichung.
|
verschreibungsfähiges BtM
|
|
Oxycodon
|
1,5-2
|
3,5-7 h (unretardiert)
|
Agonist
|
|
verschreibungsfähiges BtM
|
|
Diacetylmorphin (Heroin) / Diamorphin (DAM)
|
2,5
|
3-4 h (Metabolite)
|
Agonistsehr
|
hohes Abhängigkeitspotential
|
ausschließlich zur Herstellung von Zubereitungen zu medizinischen Zwecken verkehrsfähiges BtM, ausschließlich zur Substitutionstherapie verschreibungsfähiges BtM
|
|
Methadon
|
2
|
5-7 h
|
Agonist
|
siehe Levomethadon
|
verschreibungsfähiges BtM
|
|
Hydrocodon
|
1,5
|
4-8 h
|
Agonist
|
|
verschreibungsfähiges BtM
|
|
Morphin
|
1
|
2-4 h
|
Agonist
|
Referenzsubstanz der Opioide, eigentlich ein Opiat
|
verschreibungsfähiges BtM
|
|
Piritramid
|
0,7
|
4-6 h
|
Agonist
|
|
verschreibungsfähiges BtM
|
|
Nalbuphin
|
0,5-0,7
|
3-6 h
|
gemischter Agonist-Antagonist
|
|
nicht betäubungsmittelrechtlich geregelt
|
|
Pentazocin
|
0,3
|
2-4 h
|
gemischter Agonist-Antagonist
|
|
verschreibungsfähiges BtM
|
|
Codein
|
0,1
|
4 h
|
Agonist
|
ein Opiat
|
verschreibungsfähiges BtM, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze
|
|
Dihydrocodein
|
0,2
|
3-4 h
|
Agonist
|
|
verschreibungsfähiges BtM, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze
|
|
Pethidin
|
0,1
|
2-4 h
|
Agonist
|
|
verschreibungsfähiges BtM
|
|
Tramadol
|
0,1-0,2
|
4 h
|
Agonist
|
|
nicht betäubungsmittelrechtlich geregelt
|
|
Tilidin
|
0,1-0,2
|
3-4 h
|
Agonist
|
|
trans-Tilidin: verschreibungsfähiges Betäubungsmittel, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze und in Kombination mit Naloxon; cis-Tilidin: verkehrs-, aber nicht verschreibungsfähig.
|
|
Naloxon
|
gegen 0
|
1-4 h
|
reiner Antagonist
|
nur intravenöse Gabe
|
nicht betäubungsmittelrechtlich geregelt
|
|
Naltrexon
|
gegen 0
|
bis 24 h
|
reiner Antagonist
|
orale Gabe
|
nicht betäubungsmittelrechtlich geregelt
|
|
Loperamid
|
gegen 0
|
|
|
nur an peripheren Opioid-Rezeptoren wirksam, Behandlung des Durchfalls
|
nicht betäubungsmittelrechtlich geregelt
|
|
Apomorphin
|
gegen 0
|
|
|
Brechmitttel, an Dopamin-Rezeptoren der Area postrema
|
nicht betäubungsmittelrechtlich geregelt
|
|
 |
 |
|
Wirkungen
Analgesie
Die Schmerzbekämpfung ist die gewünschte Wirkung beim Einsatz von Opioid-Analgetika. Sie wird hauptsächlich über die μ-Rezeptoren, insbesondere μ1, jedoch auch über κ vermittelt.
Die Wirkstärke der einzelnen Substanzen wird als analgetische Potenz bezeichnet, die relativ zu Morphin angegeben wird, dessen Wert als 1 festgelegt ist. Je höher die analgetische Potenz ist, desto niedriger ist die benötigte Dosis eines Pharmakons, um eine vergleichbare Analgesie herzustellen. Phamakodynamisch kann die Potenz mit der Effektivdosis ED50 angegeben werden.
Die maximal erreichbare Analgesie besagt, dass bei niedrigpotenten Opioiden die analgetische Wirkung im Gegensatz zu hochpotenten Substanzen nur bis zu einer bestimmten Dosissteigerung zunimmt, eine weitere Erhöhung dann jedoch keine stärkere Analgesie bewirkt, jedoch eine Zunahme der unerwünschten Wirkungen. Pharmakodynamisch ist die maximal erreichbare Analgesie ein Maß der intrinsischen Aktivität eines Wirkstoffs.
Opioid-Analgetika sind Bestandteil des WHO-Stufenschemas zur Therapie chronischer Schmerzen. Dieses sieht in der zweiten Stufe die Gabe eines niederpotenten Opioids zusätzlich zu einem nicht-Opioid-Analgetikum (erste Stufe), in der dritten Stufe die Anwendung einer hochpotenten Substanz vor. Daneben werden Opioid-Analgetika in vielen weiteren Bereichen der Medizin therapeutisch eingesetzt, so zur Narkoseeinleitung in der Anästhesie und vielen akuten schmerzassoziierten Erkrankungen und Verletzungen in der Notfall- und Intensivmedizin, die mit nicht-Opioid-Schmerzmitteln nicht beherrscht werden können.[9], [6]
Zur Therapie chronischer, nicht-tumorbedingter Schmerzen sind Opioide nur eingeschränkt wirksam und nur unter Berücksichtigung der tatsächlichen Schmerzlinderung (erfassbar mittels der visuellen Analogskala), der möglichen Nebenwirkungen auch der niedrigpotenteren Schmerzmedikamente und unter zusätzlichem Einsatz zusätzlicher schmerzlindernder Maßnahmen angezeigt (siehe auch Schmerztherapie).[10]
Atemdepression
Die unerwünschte Atemdepression (als verminderte Ansprechbarkeit des Atemzentrums auf Atemantriebe) wird durch eine verminderte CO2-Empfindlichkeit des Atemzentrums über μ2-Rezeptoren ausgelöst. Sie ist direkt proportional zur analgetischen Potenz des Opioids. Indirekt hat sie durch eine Vasodilatation (Gefäßweitstellung) auch eine Erhöhung des intrakraniellen Drucks (Hirndruck) zur Folge. Als milde Verlaufsform tritt eine Hypoventilation (verminderte Atmung) mit nur wenigen Atemzügen pro Minute auf. Typisch für diese ist, dass der Betroffene einer Aufforderung zum aktiven Atmen nachkommt (sogenannte Kommandoatmung). Bei höherer Dosierung sisitiert die Atmung komplett (Atemstillstand). Durch den Einsatz des Antagonisten Naloxon ist eine Atemdepression aufhebbar.
Bei schmerzorientierter Gabe von Opioiden tritt in der Regel keine klinisch relevante Atemdepression auf, solange sich die Opioidgabe am Ausmaß der Schmerzreduktion orientiert und eine Überdosierung vermieden wird. Schmerz ist bezüglich Atemdepression ein Opioidantagonist.[11]
Atemnottherapie in der Palliativmedizin
Opioide können gerade in der Behandlung einer Dyspnoe als Folge fortgeschrittener Erkrankungen wie einer COPD zumindest im Terminalstadium einer Erkrankung verabreicht werden, sofern die Symptomlinderung und nicht die Beschleunigung des Sterbeprozesses angestrebt wird.[12][13] Darüber hinaus sind Opioide auch zur Linderung einer anderweitig nicht zu behandelnden Atemnot von COPD-Patienten außerhalb eines Terminalstadiums hilfreich.[14][15] Zum Einsatz kann z.b. Morphin mittels intravenöser oder subcutaner Injektion erfolgen, eine andere Möglichkeit ist die Gabe von nasal zu verabreichendem Fentanyl.[16]
Psychotrope Effekte
Eine Sedierung (Beruhigung) wird über κ-Rezeptoren bewirkt. Sie ist teilweise erwünscht (Narkose, Analgosedierung), teilweise unerwünscht (langfristige Schmerztherapie). Auch bei hoher Dosierung von Opioid-Analgetika kommt es jedoch nicht zur sicheren Ausschaltung des Bewusstseins, so dass Opioide im Rahmen einer Allgemeinanästhesie (Narkose) mit inhalativen oder intravenösen Hypnotika kombiniert werden müssen, um Wachheits-Phänomene (Awareness) zu vermeiden.
Opioide haben weiterhin angstlösende und euphorisierende Effekte, die als verantwortlich für die psychische Komponente einer Opioid-Abhängigkeit angesehen werden. Daneben können über σ-Rezeptoren jedoch auch Dysphorie und Halluzinationen verursacht werden, was bei den gemischten Agonisten-Antagonisten eine Rolle spielt.
Übelkeit und Erbrechen
Durch die Stimulation Dopamin-abhängiger Rezeptoren in der Triggerzone der Area postrema am Boden des IV. Ventrikel wird das Brechzentrum in der Formatio reticularis stimuliert und so Übelkeit und Erbrechen (emetische Wirkung) ausgelöst. Im Rahmen einer Narkose kann dies postoperativ auftreten (postoperative nausea and vomiting, PONV). Diese Wirkung kann durch Antiemetika gemildert werden. In höherer Dosierung dämpfen Opioide das Brechzentrum jedoch, so dass dann eine antiemetische (übelkeitsmindernde) Wirkung resultiert.
Das dem Morphin verwandte Apomorphin hat eine ausgeprägte Wirkung an den Dopamin-2-Rezeptoren der Area postrema. Es kann aus diesem Grund zum Auslösen von Erbrechen bei manchen Vergiftungen genutzt werden, ist jedoch in Deutschland für diese Indikation (beim Menschen) nicht mehr zugelassen.
Weitere Wirkungen
Spastische Obstipationen des Darms (Verstopfung) werden durch die Stimulierung von μ-Rezeptoren des Plexus myentericus der Darmwand mit einer Konstriktion der glatten Muskulatur bewirkt. Sie sind die relevanteste Nebenwirkung bei langfristiger Schmerzbehandlung und unterliegt nur einer geringen Toleranzentwicklung. Prophylaktisch kann die Gabe von Laktulose erfolgen. Gewünscht ist die obstipierende Wirkung beim Einsatz des Morphin-Abkömmlings Loperamid, das als Antidiarrhoicum zur symptomatischen Therapie von schwerem Durchfall dient.
Weiter kommt es zu einer Konstriktion des Sphincter oddi, wodurch der Druck im Gallengangsystem erhöht wird, was zu kolikartigen Schmerzen führen kann. Daneben ist eine Sekretstauung des Pankreas und in der Folge eine Pankreatitis möglich.
Durch denselben Mechanismus treten Entleerungsstörungen der Harnblase mit Harnverhalt auf.
Durch die Dämpfung des Hustenzentrums kommt es zu einer antitussiven (hustenmildernden) Wirkung. Selektiv ist diese für das Opiat Noscapin beschrieben. Diese Wirkung wird bei dem Antitussivum Codein und Derivaten genutzt. Bei der schnellen Injektion von hochpotenten synthetischen Analgetika wie Fentanyl bei der Narkoseeinleitung kann es initial jedoch zu einem Hustenreiz kommen, was das Aspirationsrisiko erhöht.
Opioide bewirken eine zentrale Sympathikolyse (Aktivitätsminderung des sympathischen Nervensystem). Durch diese sowie eine Erhöhung der Aktivität des Nervus vagus sowie einer direkten Vasodilatation kommt es zu einem Abfall der Herzfrequenz (Bradykardie), des Blutdruckes (Hypotonie) sowie des Herzzeitvolumens. In therapeutisch üblicher Dosierung ist die Beeinträchtigung der Herz-Kreislauffunktion nur gering. Bei eingeschränkter Kreislaufregulation wie bei Volumenmangel (Schock), Narkose sowie unter Antihypertensiva (blutdrucksenkende Medikamente) ist jedoch ein krisenhafter Blutdruckabfall möglich. Bei der Therapie des akuten Myokardinfarktes (Herzinfarkt) und der akuten Linksherzinsuffizienz (Herzschwäche) nutzt man die kreislaufdämpfende Wirkung zur Entlastung der Herzfunktion und zur Senkung des myokardialen Sauerstoffverbrauchs.
Eine Miosis (Verengung der Pupille) wird durch die Stimulation des parasympathischen Edinger-Westphal-Kern im Mittelhirn und die dadurch verursachte Kontraktion des Musculus sphincter pupillae ausgelöst. Beim Vorliegen einer Opioid-Vergiftung mit Sauerstoffmangel (s. u.) kann auch einen Mydriasis (Erweiterung der Pupille) auftreten.
Bolusinjektionen hochpotenter Opioide im Rahmen der Narkose können eine Muskelrigidität (Muskelsteifigkeit) auslösen, die vor allem Thorax (Brustkorb) und Abdomen (Bauch) betrifft (wooden chest), wodurch die Maskenbeatmung bei der Narkoseeinleitung erschwert wird. Der Mechanismus ist unklar. Besonders ausgeprägt ist diese unerwünschte Wirkung bei Alfentanil und Remifentanil. Im Rahmen der modernen Kombinationsnarkose spielt dieses Phänomen aufgrund der eingesetzten Muskelrelaxanzien nur noch eine untergeordnete Rolle.
Opioide können weiterhin Juckreiz (Pruritus) auslösen. Dies kommt durch eine Überlappung von Schmerz- und Juckreiz-assoziierten peripheren Mediatoren und Rezeptoren zustande.[17]
Opioide sind keine Trigger für die maligne Hyperthermie und haben keine toxische (giftige) Wirkung auf Leber und Niere. Sie setzen Histamin frei.
Intoxikation
Eine akute Intoxikation mit Opioiden kann im Rahmen einer Überdosierung bei Abhängigkeit, meist in Unkenntnis der Opioid-Konzentration sowie in suizidaler Absicht, akzidentiell (unabsichtlich), iatrogen (als Folge einer medizinischen Behandlung) oder auch bei einem Body-Packer-Syndrom bei Drogenkurieren kommen.
Die typische Symptomen-Trias der Opioid-Intoxikation besteht aus Atemdepression, nicht erweckbarem Koma und Miosis mit stecknadelkopfgroßen Pupillen. Bei tiefer Bewusstlosigkeit kann jedoch auch eine Mydriasis auftreten. Durch die insuffiziente Atmung besteht eine Hypoxie (Sauerstoffmangel) mit Zyanose, unter Umständen kann es zu einem Lungenödem kommen. Eventuell kann eine Cheyne-Stokes-Atmung beobachtet werden. Weiterhin tritt eine Kreislaufschwäche mit Bradykardie (Pulsverlangsamung) und Hypotension (Blutdruckabfall) ein. Der Muskeltonus ist herabgesetzt, die Reflexe sind abgeschwächt oder aufgehoben. Differenzialdiagnostisch kommt eine Vergiftung mit Clonidin in Betracht, deren Erscheinungsbild sehr ähnlich sein kann.
Die Therapie einer Opioid-Vergiftung ist primär symptomatisch und besteht in der Sicherung der Vitalfunktionen. Die wichtigste Maßnahme ist das Freihalten der Atemwege bei Ateminsuffizienz, falls erforderlich durch eine endotracheale Intubation und kontrollierte Beatmung mit Sauerstoff. Die Kreislaufinsuffizienz macht eine Schockbehandlung mit Volumengabe über großlumige Venenverweilkanülen erforderlich. Auftretende Krämpfe werden mit Benzodiazepinen behandelt.
Als spezifisches Antidot wird Naloxon eingesetzt, das als Antagonist an allen Opioid-Rezeptoren wirkt. Dieses wird in repetetiven Gaben bis zur deutlichen Besserung der klinischen Symptomatik eingesetzt (Titrationsantagonisierung). Vorsicht ist bei Abhängigen geboten, bei denen dadurch ein akutes Entzugssyndrom ausgelöst werden kann. Bei der Antagonisierung von längerwirksamen Opioiden kann es aufgrund der recht kurzen Halbwertszeit von Naloxon zu einem Rebound-Phänomen, der Remorphinisierung, kommen.[7]
Toleranz, Abhängigkeit, Entzug
Die Toleranzentwicklung (Gewöhnung) bei Opioiden bezeichnet die Wirkungsabschwächung und Verkürzung der Wirkdauer bei wiederholter Zufuhr, die durch eine Dosiserhöhung ausgeglichen wird. Es handelt sich um eine pharmakodynamische Toleranz, die hauptsächlich auf einer gesteigerten Enzymaktivität der intrazellulären Adenylatzyklase beruht.[18]
Die Toleranzausbildung ist charakteristischerweise für die analgetische, euphorische und atemdepressive Wirkung schneller als für die spasmogenen peripheren Effekte und die Miosis. Bei endogenen Opioiden wird die Toleranzentwicklung durch eine Aufnahme und Aufarbeitung der Rezeptoren in die Zelle verhindert.[19] Bei unterbrochener Opioidzufuhr kommt es zur Entzugssymptomatik, die auf einer vermehrten Freisetzung von Noradrenalin beruht. Die Entzugssymptomatik ist mit ein Diagnosekriterium für eine entstandene Abhängigkeit.[20]
Ein Entzug von Opioiden kann im ambulanten oder stationären Bereich bzw. ohne ärztliche Hilfe als sog. "kalter Entzug" oder mit "qualifizierten" Methoden durchgeführt werden. Der Schweregrad des Opioidentzugssyndrom kann mittels verschiedener validierter Beurteilungsbögen erhoben werden und ist abhängig von mehreren Faktoren. Eine psychosoziale Betreuung, die im Übrigen auch ein begünstigender Faktor für einen erfolgreichen Entzug an und für sich ist, soll diesem folgen, da damit eine länger dauernde bzw. anhaltende Abstinenz erleichtert wird. Eine psychosoziale Betreuung wird auch für Personen, die sich in Substitutionsprogrammen befinden, gefordert. Letztere sind die anerkannte Therapie für eine Abhängigkeit von Opioiden, insbesondere der Heroin-Abhängigkeit.
Werden Opioide zur Schmerztherapie eingesetzt, tritt eine Toleranzentwicklung und Abhängigkeit (bei ausreichender und zeitkonstanter Dosierung) nicht auf. Ein lautstarkes Verlangen nach vermehrten Opioidgaben ist hier als Zeichen einer Unterdosierung zu werten.[2]
Rechtliche Aspekte
Den nationalen Gesetzen liegt das Einheitsabkommen über die Betäubungsmittel zugrunde, vormals Internationales Opiumabkommen.
In Deutschland wird die Verkehrsfähigkeit von Betäubungsmitteln durch das Betäubungsmittelgesetz (BtMG) geregelt.[21] Opioide unterliegen dem Betäubungsmittelgesetz je nach Sucht- bzw. Missbrauchspotential entweder in allen Konzentrationen (siehe auch Übersichtstabelle), ab einer bestimmten Konzentration (Codein, Tilidin mit Naloxon, Dextropropoxyphen) oder aber überhaupt nicht (Tramadol und Nalbuphin).
In der Schweiz und Österreich gelten vergleichbare Gesetze (Betäubungsmittelgesetz (Schweiz),[22] Suchtmittelgesetz (Österreich)).
Literatur
- Eckart J, Jaeger K, Möllhoff Th. (Hrsg).: Kompendium Anästhesiologie, ecomed 2010 ISBN 978-3-609-71361-8.
- Karow, Lang-Roth: Allgemeine und spezielle Pharmakologie und Toxikologie. 14. Auflage 2005. Eigenverlag.
- S3-Leitlinie: Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS), AWMF-Registernummer 041/003 (online: Volltext ), Stand 06/2009
Einzelnachweise
- ↑ Porter J, Jick H: Addiction rare in patients treated with narcotics. New England Journal of Medicine 302: 123, 1980
- ↑ a b Enno Freye: "Opioide in der Medizin". 8. Aufl., Springer, 2010
- ↑ Fachinformation Meptid(R) Stand September 2007
- ↑ Rowbotham DJ:Endogenous opioids, placebo response, and pain. Lancet. 2001 Jun 16;357(9272):1901-2. PMID 11425407
- ↑ Lüllmann, Mohr: Pharmakologie und Toxikologie, 15. Auflage 2003. ISBN 3-13-368515-5
- ↑ a b Jochen Schulte am Esch, Hanswerner Bause, Eberhard Kochs: Anästhesie, Intensivmedizin, Notfallmedizin, Schmerztherapie. Thieme, Stuttgart; 3. Auflage 2006. ISBN 3-13-119083-3
- ↑ a b Karow, Lang-Roth: allgemeine und spezielle Pharmakologie und Toxikologie. 14. Auflage 2005. Eigenverlag.
- ↑ Frank Detlev, Richling Schneider: Fakten. Arzneimittel 2007. Thieme, Stuttgart 2006, ISBN 3-13-140543-0
- ↑ McQuay H: Opioids in pain management. Review. Lancet. 1999 Jun 26;353(9171):2229-2232. PMID 10393001 .
- ↑ [1] AWMF Leitlinie Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS), abgerufen am 25.Juli 2011
- ↑ Husebø/Klaschik: "Palliativmedizin"; Springer Medizin Verlag Heidelberg, 2006, 4. Auflage ISBN 978-3-540-29888-5.
- ↑ Jennings AJ, Davies AN, Higgins JPT, et al. A systematic review of the use of opioids in the management of dyspnoea. Thorax. 2002;57:939–44 (englisch). Thorax.bmj.com. Abgerufen am 27. Januar 2011.
- ↑ James R Runo and E Wesley Ely: "Treating dyspnea in a patient with advanced chronic obstructive pulmonary disease - Evidence-Based Case Review" West J Med. 2001 September; 175(3): 197–201. PMC1071542 (englisch). Western Journal of Medicine. Abgerufen am 27. Januar 2011.
- ↑ Rocker G, Horton R, Currow D, Goodridge D, Young J, Booth S.: „Palliation of dyspnoea in advanced COPD: revisiting a role for opioids.“ Thorax. 2009 Oct;64(10):910-915. PMID 19786716.
- ↑ Varkey B.: „Opioids for palliation of refractory dyspnea in chronic obstructive pulmonary disease patients.“ Curr Opin Pulm Med. 2010 Mar;16(2):150-154. PMID 20071992 .
- ↑ Atemnot in der Palliativversorgung, Schmerztherapie, DGS, Ausgabe 2/2011, 27.Jg.
- ↑ Ikoma A et al:The neurobiology of itch. Nat Rev Neurosci. 2006 Jul;7(7):535-47. Review. PMID 16791143
- ↑ Freye E, Latasch L: Toleranzentwicklung unter Opioidgabe - Molekulare Mechanismen und klinische Bedeutung. Anasthesiol Intensivmed Notfallmed Schmerzther. 2003 Jan;38(1):14-26. PMID 12522725
- ↑ Koch T et al.: Receptor endocytosis counteracts the development of opioid tolerance. Mol Pharmacol. 2005 Jan;67(1):280-7 PMID 15475572
- ↑ Cami J, Farre M: Drug addiction. N Engl J Med. 2003 Sep 4;349(10):975-86. Review. PMID 12954747
- ↑ Gesetz über den Verkehr mit Betäubungsmitteln (online )
- ↑ Bundesgesetz über die Betäubungsmittel und die psychotropen Stoffe (Betäubungsmittelgesetz, BetmG) (online )
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 26.04. 2012 aus dem Internet abgerufen.
|
 |
 |
|
α2-Adrenozeptor
Die α2-Adrenozeptoren sind im zentralen und peripheren Nervensystem vorkommende Rezeptoren, die durch Adrenalin und Noradrenalin aktiviert werden. Sie vermitteln ihre Effekte über inhibitorische Gi/o-Proteine. Auf Grund ihrer pharmakologischen Eigenschaften werden sie in vier Subtypen unterteilt: α2A, α2B, α2C und α2D, wobei der α2D-Subtyp eine bei Nagetieren vorkommende Variante des humanen α2A-Adrenozeptors darstellt.
Vorkommen und Funktion
α2-Adrenozeptoren kommen in hoher Dichte sowohl prä- als auch postsynaptisch (siehe Synaptischer Spalt) im Zentralnervensystem und im peripheren Nervensystem vor. Im Zentralnervensystem führt eine Aktivierung von α2-Adrenozeptoren zu überwiegend inhibitorischen Effekten: Hemmung der Transmitterfreisetzung, Analgesie, Sedierung, Zentrale Blutdrucksenkung und Hypothermie. Periphere Funktionen schließen eine Vasokonstriktion (paradoxe Clonidinwirkung nach i.v.-Applikation) und eine Förderung der Thrombozytenaggregation ein.
Pharmakologie
α2-Adrenozeptor-Agonisten verhalten sich über einen physiologisch gesehen negativen Feedbackmechanismus effektiv sympatholytisch: "indirekte Sympatholytika oder AntiSympathotonika". α2-Rezeptor-Interaktion führt zur Abnahme der Aktionspotentialfrequenz des sympathischen Teils des vegetativen Nervensystems. Therapeutisch werden sie daher
- zur Behandlung der arteriellen Hypertonie (Clonidin) eingesetzt.
- zur Senkung des Augeninnendrucks beim chronischen Weitwinkelglaukom (Clonidin, Brimonidin und Dipivefrin) eingesetzt.
- als zentral wirksames Muskelrelaxans (Tizanidin) durch die Hemmung exzitatorischer Interneurone eingesetzt. Tizanidin wird klinisch bei zentral bedingter Spastik und schmerzbedingten Muskelverspannungen angewendet.
- Daneben werden α2-Adrenozeptor-Agonisten in der Veterinärmedizin auch als Sedativa und Narkotika eingesetzt (z.B. Xylazin, Detomidin, Medetomidin)
α2-Adrenozeptor-Antagonisten wirken über den oben erwähnten negativen Feedbackmechanismus als indirekte Sympathomimetika: sie erhöhen die Aktionspotentialfrequenz des sympathischen Nervensystems. Therapeutisch werden sie zur Steigerung der männlichen Sexualfunktion (Yohimbin) und als Antidepressiva (Mianserin, Mirtazapin und Idazoxan) eingesetzt.
Pharmakologische Eigenschaften und Funktion der α2-Adrenozeptoren
|
 |
|
|
|
Eigenschaft
|
α2A/D
|
α2B
|
α2C
|
|
Agonisten
|
Adrenalin, Noradrenalin, Clonidin, Brimonidin
|
|
Selektive Agonisten
|
Guanfacin
|
–
|
–
|
|
Antagonisten
|
RS 79948, RX821002, Yohimbin, Rauwolscin
|
|
Selektive Antagonisten
|
BRL44408
|
ARC 239
|
–
|
|
Funktion
|
Hypotension, Sedierung, Analgesie, Plättchenaggregation
|
Vasokonstriktion
|
–
|
|
 |
 |
|
Signalübertragungswege am α2-Adrenozeptor
- Hemmung der Adenylylcyclase
- Mobilisierung von Calcium-Ionen aus intrazellulären Speichern
- Stimulation des Calcium-Einstroms durch L-Typ Kanäle
- Hemmung des Calcium-Einstroms durch N-Typ Kanäle
- Aktivierung von Kalium-Kanälen
- Aktivierung des Natrium-/Wasserstoff-Antiports
Literatur
- Guimarães S, Moura D: Vascular adrenoceptors: an update. In: Pharmacol. Rev.. 53, Nr. 2, Juni 2001, S. 319–56. PMID 11356987 .
- Alexander SPH, Mathie A, Peters JA: Guide to Receptors and Channels (GRAC), 4th Edition. In: Br. J. Pharmacol.. 158 Suppl 1, November 2009, S. S1–254. doi:10.1111/j.1476-5381.2009.00499.x . PMID 19883461 .
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 26.04. 2012 aus dem Internet abgerufen.
|
 |
 |
|
Diazepam
Diazepam (Handelsname u.a. Valium) ist ein Arzneistoff aus der Gruppe der Benzodiazepine mit relativ langer Halbwertszeit. Er wird insbesondere als Psychopharmakon zur Behandlung von Angstzuständen, in der Therapie epileptischer Anfälle und als Schlafmittel angewendet. Da es bei einer Langzeittherapie mit Diazepam zu einer psychischen und körperlichen Abhängigkeit kommen kann, wird der Wirkstoff vorrangig in der Akuttherapie – das heißt nicht länger als vier bis sechs Wochen – eingesetzt.[3] Eine Anwendung über längere Zeit darf nur unter sorgfältiger ärztlicher Überwachung erfolgen. Diazepam wurde von der Weltgesundheitsorganisation (WHO) in die „Liste der unentbehrlichen Medikamente“ aufgenommen, welche zum Ziel hat, allen Menschen weltweit Zugang zu den notwendigsten Arzneimitteln zu sichern.[4]
Klinische Angaben
Diazepam wirkt anxiolytisch (angstlösend), antikonvulsiv (antiepileptisch), muskelrelaxierend (muskelentspannend) und sedierend (beruhigend). Es hat eine lange Halbwertszeit (24 bis 48 Stunden) und zeigt wegen der hohen Lipidlöslichkeit und der daher guten Passage der Blut-Hirn-Schranke einen raschen Wirkungseintritt, hat aber wegen einer raschen Umverteilung aus dem Gehirn nur eine kurze Wirkdauer (i. v. „Bolus“ Diazepam nur 10 bis 20 Minuten). Auch seine Abbauprodukte sind pharmakologisch aktiv (Halbwertszeit von 50 bis 80 Stunden). Der Abbau von Diazepam ist altersabhängig. Die Halbwertszeit beträgt bei Erwachsenen mittleren Alters etwa 30 Stunden, während sie bei 60- bis 90-Jährigen um die 81 Stunden liegt.
Anwendungsgebiete (Indikationen)
Neben seiner Anwendung zur symptomatischen Behandlung von akuten Spannungs-, Erregungs- und Angstzuständen wird Diazepam in der Prämedikation vor chirurgischen und diagnostischen Eingriffen eingesetzt. Ebenso findet es Verwendung als Muskelrelaxans und als Notfalltherapeutikum zur Behandlung epileptischer Grand-mal-Anfälle sowie, falls Anzeichen vorher bemerkbar sind, zu deren Vermeidung (siehe Antikonvulsivum). Wegen der Gefahr einer Abhängigkeitsentwicklung sollte die Behandlungsdauer so kurz wie möglich sein. Diazepam sollte bei Patienten mit Alkohol-, Arzneimittel- oder Drogenabhängigkeit in der Vorgeschichte nur mit äußerster Vorsicht verwendet werden.[5] Weiter wird Diazepam auch intravenös (i. v.) als lebensrettendes Antidot bei Chloroquin-Vergiftungen angewendet.[6][7]
Kontraindikationen
Falls Patienten unter schweren Atembeschwerden, unter nächtlichem Erwachen wegen Unterbrechung der Atmung (Schlafapnoe-Syndrom), unter Lebererkrankung oder krankhafter Muskelschwäche (sogenannter Myasthenia gravis) leiden, oder falls sie von einem Beruhigungsmittel einschließlich Alkohol abhängig sind, dürfen sie Diazepam nicht einnehmen.
Abhängigkeit
Diazepam kann bei regelmäßiger Einnahme über einen längeren Zeitraum insbesondere psychische, aber auch physische Abhängigkeit hervorrufen. Dies gilt nicht nur für die missbräuchliche Verwendung, sondern auch für den therapeutischen Dosisbereich. In Deutschland sind etwa 1,9 Millionen Menschen von Substanzen der Stoffklasse der Benzodiazepine abhängig. Das plötzliche Absetzen der Therapie nach längerer Anwendung kann starke Entzugserscheinungen hervorrufen.
Anwendung in der Schwangerschaft
Bei einigen Studien wurden Herzfehlbildungen, Lippen-/Gaumenspalten und komplexe andere Fehlbildungen beschrieben. Andere Studien konnten teratogene Effekte nicht bestätigen. Es liegen nicht genügend Studien über die spätere Entwicklung des Kindes vor, um darüber sichere Aussagen treffen zu können.[8] Es liegen einzelne Fallberichte über Fehlbildungen und geistige Behinderung der pränatal exponierten Kinder nach Überdosierungen und Vergiftungen vor. Tierversuche haben Hinweise auf Verhaltensstörungen bei Nachkommen von Muttertieren, die Diazepam erhielten, ergeben.[5]
Wechselwirkungen mit anderen Medikamenten
Andere auf das Gehirn wirkende Arzneimittel (zum Beispiel Beruhigungsmittel, Schlafmittel, Mittel gegen Depressionen, verschiedene Schmerzmittel, Arzneimittel gegen Anfallsleiden (Antiepileptika) oder muskelrelaxierende Mittel), ebenso gewisse Arzneimittel gegen Magen-Ulkus, Tuberkulose, Pilzerkrankungen, Asthma oder zur Alkoholentwöhnung und Diazepam können einander unter Umständen beeinflussen. Diazepam wird über das Cytochrom P450-Enzymsystem (CYP 3A4) abgebaut. Hemmstoffe dieses Enzymsystems (z. B. Cimetidin) führen zu einem verlangsamten Abbau von Diazepam verbunden mit dessen verlängerter oder verstärkter Wirkung. Weiterhin verstärkt Diazepam die Wirkung anderer Muskelrelaxantien sowie die Wirkung von Lachgas und Analgetika. Die Anwendung von Diazepam und Omeprazol, Cimetidin, Ketoconazol, Fluvoxamin, Fluoxetin sollte vermieden werden, da diese Substanzen den Abbau von Diazepam verlangsamen.[9]
Warnhinweise
Während der Einnahme von Diazepam darf kein Alkohol konsumiert werden. Bei der Kombination von Diazepam mit anderen zentral wirkenden Pharmaka wie Neuroleptika, Anxiolytika/Sedativa, Antidepressiva, Hypnotika, Antikonvulsiva, Narkoanalgetika, Anästhetika und sedierenden Antihistaminika ist zu berücksichtigen, dass ihre Wirkungen sich gegenseitig verstärken können. Es ist bekannt, dass es bei Verwendung von Diazepam zu paradoxen Reaktionen wie Ruhelosigkeit, Agitation, Reizbarkeit, Aggressivität, Wahnvorstellungen, Wutausbrüchen, Albträumen, Halluzinationen, Psychosen, auffälligem Verhalten und anderen Verhaltensstörungen kommen kann. Beim Absetzen von Diazepam können Rebound-Symptome auftreten. Die ursprünglichen Symptome, die zur Behandlung mit Diazepam führten, können verstärkt auftreten.[5]
Unerwünschte Wirkungen (Nebenwirkungen)
Diazepam führt zu einer Reduktion des Skelettmuskeltonus und zur Schläfrigkeit und beeinträchtigt dadurch das Reaktionsvermögen auf längere Zeit.
Entzugserscheinungen können sein: Angstzustände, Halluzinationen, Krampfanfälle, Psychosen, Überempfindlichkeit gegenüber Geräuschen und Licht, optische Wahrnehmungsverzerrung, übermäßiges Gefühlserleben. Einen detaillierten Überblick geben Studien C. H. Ashton.[10]
Mögliche Nebenwirkungen bei Diazepam sind:
Müdigkeit, starke Tagessedierung, Benommenheit, Schläfrigkeit, Mattigkeit, Schwindelgefühl, Kopfschmerzen, Ataxie, verlängerte Reaktionszeit, Verwirrtheit, anterograde Amnesie. Überhangeffekte (Konzentrationsstörungen, Restmüdigkeit), Beeinträchtigung der Reaktionsfähigkeit.
Bei hohen Dosen und besonders bei Langzeitbehandlung mit Diazepam:
Artikulationsstörungen, Bewegungsunsicherheit und Gangunsicherheit, Doppelbilder, Nystagmus, Erregungszustände, Angst (Wirkungsumkehr), vermehrte Muskelkrämpfe, Einschlafstörungen und Durchschlafstörungen, Wutanfälle, Halluzinationen, Suizidalität. Derealisations- und Depersonalisationserleben sowie Gefühlskälte und Kritikschwäche sind typisch für eine Langzeitanwendung mit Diazepam.
Erscheinungen bei einer Abhängigkeitsanamnese:
Persönlichkeitswandel: Gleichgültigkeit, Antriebsverlust, dysphorische Verstimmung, gleichgültige bis euphorische Grundstimmung (inhaltsloses Glücksgefühl), fehlende Belastungs- und Konfliktfähigkeit, fehlende Vorausplanung („in den Tag hineinleben“), Einschränkung der Aufmerksamkeit, Konzentrationsstörung, allgemeine seelisch-körperliche (psychomotorische) Verlangsamung, Reaktionszeitverlangsamung mit potentiell gefährlichen Folgen im Verkehr, Beruf und Haushalt, Vergesslichkeit (Erinnerungslücken): Gedächtniseinbußen hinsichtlich der Aufnahme neuer Informationen in den Langzeitspeicher, nicht dagegen hinsichtlich der Erinnerungsfähigkeit an früher (vor dem Missbrauch) gelernter Inhalte, hirnorganisches Psychosyndrom bzw. arzneimittelbedingte Demenz bei älteren Personen, deren Stoffwechsel langwirkende Benzodiazepine und ihre aktiven Zwischenprodukte nur sehr langsam abbauen kann, mangelnde Belastbarkeit mit Leistungsabfall, dysphorisch-depressive Verstimmung, wechselnde Verstimmungszustände, gemütsmäßiger Kontrollverlust mit Reizbarkeit und aggressiven Durchbrüchen, manchmal regelrecht feindseliges Verhalten, innere Unruhe, Nervosität, Fahrigkeit, unerklärliche und unbestimmte Angstzustände: Tranquilizer verstärken langfristig die ursprünglich vorhandene Angst (nach spätestens vier Monaten bleiben angst-dämpfende Effekte überhaupt aus), zunehmende Furchtbereitschaft (vor Situationen, Personen, Dingen), Flucht vor der Realität (Vermeidungsverhalten), gelegentlich Orientierungsstörung (örtlich, zeitlich, zur eigenen Person, im Extremfall Verwirrtheitszustände), unerklärliche Bewusstseinstrübungen, delirähnliche Zustände, wahnhafte Reaktionen mit Trugwahrnehmung.
Symptome der Überdosierung (Nebenwirkungen)
Bei Überdosierung können Schwindelgefühle und kurzzeitige Amnesie auftreten sowie starke Koordinationsstörungen und Lispeln. Dazu kann Diazepam in hoher Überdosierung eine Atemdepression bis hin zum Atemstillstand hervorrufen. Dabei kommt es unter anderem zum Blutdruckabfall bis hin zum Herzkreislaufstillstand. Bei Überdosierung sollte der Notarzt verständigt werden.
Wichtig ist auch der Hinweis zur Halbwertszeit von Diazepam: Die Halbwertszeit beträgt zwischen 48 und 60 Stunden, d. h., nach dieser Zeit wirkt noch die Hälfte der ursprünglichen Dosis im Körper. Bei wiederholter Einnahme an mehreren darauffolgenden Tagen kommt es zu einer Anreicherung der Substanz im Körper.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Diazepam wirkt als allosterischer Modulator des GABAA-Rezeptors und verstärkt die inhibitorische Wirkung des Neurotransmitters γ-Aminobuttersäure (GABA). Dabei bindet Diazepam als Agonist an die Benzodiazepinbindungsstelle dieses Rezeptors (ein Chlorid-Ionenkanal) und bewirkt so seine konformationelle Änderung; diese erhöht die Rezeptor-Empfindlichkeit gegenüber GABA. Eine verstärkte GABA-Aktivität resultiert in einer erhöhten Öffnungsrate am Chloridkanal und damit in einem verstärkten Einstrom von Chloridionen in die Zelle. Die Erhöhung der intrazellulären Chloridkonzentration führt durch Hyperpolarisation zu einer verminderten Erregbarkeit der Zelle.
Pharmakokinetik
Diazepam wird nach oraler Einnahme fast vollständig resorbiert. Die Verstoffwechslung umfasst vorwiegend die Schritte N-Demethylierung und Hydroxylierung und liefert die aktiven Abbaustoffe Desmethyldiazepam, Temazepam und Oxazepam.
Toxikologie
Als Antidot (Gegengift) bei Vergiftungen mit Benzodiazepinen wird Flumazenil (Handelsname Anexate) verwendet (ein spezifischer Antagonist).
Chemie
Diazepam ist ein N-methyliertes Benzodiazepin. Als solches ist es durch eine Lactamstruktur gekennzeichnet. Diazepam wurde Mitte der 1950er Jahre erstmals durch Leo Sternbach ausgehend von Chlordiazepoxid synthetisiert.[11] Alternativ dazu veröffentlichte Leo Sternbach einen Syntheseweg ausgehend von p-Chloranilin über 2-Amino-5-chlorbenzophenon und Glycinethylesterhydrochlorid.[12]
Geschichte
Diazepam wurde von Leo Sternbach entwickelt und erstmals 1963 von der Firma F. Hoffmann-La Roche unter dem Handelsnamen Valium auf den Markt gebracht. Nach Chlordiazepoxid (Librium) 1960 war es das zweite Benzodiazepin. In Deutschland war Diazepam noch 2005 das am häufigsten verordnete Benzodiazepin.[13]
Handelsnamen
Monopräparate
Faustan (D), Gewacalm (A), Paceum (CH), Psychopax (A, CH), Stesolid (D, A, CH), Valiquid (D), Valium (D, A, CH), Valocordin-Diazepam (D), diverse Generika (D, CH)
Kombinationspräparate
Betamed (A), Hamomed (A) [14][15][16]
Literatur
- L. H. Sternbach (1979): The Benzodiazepine Story. In: J. Med. Chem. Bd. 22, S. 1–7. PMID 34039
- Fachinformation für Valium, Roche Pharmaceuticals
- Borwin Bandelow et al. Handbuch der Arzneimitteltherapie, Bd. 1, Psychopharmaka, 2nd edition. Enke, 2004. ISBN 3-13-113041-5.
- Otto Benkert et al. Kompendium der Psychiatrischen Pharmakotherapie, 5th edition. Springer, 2003. ISBN 3-540-21893-9.
Einzelnachweise
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f g h Datenblatt Diazepam bei Sigma-Aldrich, abgerufen am 24. März 2011.
- ↑ Martin Wehling (Hrsg.:): Klinische Pharmakologie. 1. Auflage. Georg Thieme Verlag, Stuttgart 2005. S. 487
- ↑ Essential Medicines 15th edition (March 2007) WHO Model List 2007) (PDF, 607 KB)
- ↑ a b c Fachinformation des Arzneimittel-Kompendium der Schweiz: Valium, Stand der Informationen: Februar 2006
- ↑ Antidottarium der Roten Liste
- ↑ Chloroquin bei Toxinfo.org , Toxikologische Abteilung der II. Medizinischen Klinik der Technischen Universität München
- ↑ Anke Rohde, Christof Schaefer: Schwangerschaft, Stillzeit und psychische Störungen Stand: 21. April 2008
- ↑ Fachinformation des Arzneimittel-Kompendium der Schweiz: Paceum, Stand der Informationen: Februar 2006
- ↑ http://www.xxx
- ↑ L. H. Sternbach, S. Kaiser, E. Reeder: Quinazoline 3-Oxide Structure of Compounds Previously Described in the Literature as 3.1.4-Benzoxadiazepines, in: J. Am. Chem. Soc 1960, 82, 475–480; doi:10.1021/ja01487a058 .
- ↑ L. H. Sternbach, E. Reeder, O. Keller, W. Metlesics: Quinazolines and 1,4-Benzodiazepines. III. Substituted 2-Amino-5-phenyl-3H-1,4-benzodiazepine 4-Oxides. In: J. Org. Chem. 1961, 26, S. 4488–4497; doi:10.1021/jo01069a069 .
- ↑ ePsy.de Psychopharmaka in der Praxis 2005
- ↑ Rote Liste online, Stand: September 2009
- ↑ AM-Komp. d. Schweiz, Stand: September 2009
- ↑ AGES-PharmMed, Stand: September 2009
xxx – Entsprechend unserer Statuten werden uns unbekannte Webadressen nicht veröffentlicht .Für eine weiterführende Recherche gehen Sie bitte auf die entsprechende Wikipediaseite. Mehr Informationen lesen Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 27.04. 2012 aus dem Internet abgerufen.
|
 |
 |
|
Flunitrazepam
Flunitrazepam ist ein Wirkstoff aus der Gruppe der Benzodiazepine. Es wird vorwiegend als Schlafmittel verschrieben sowie vor chirurgischen oder diagnostischen Eingriffen und gelegentlich auch noch anschließend kurzfristig zur Sedierung des Patienten angewendet.
Geschichte und Synthese
Flunitrazepam wurde erstmals 1972 von Hoffmann-La Roche hergestellt und patentiert. Das Präparat kam 1975 auf den europäischen Markt und wurde seit 1980 auch außerhalb von Europa zugelassen. Ab den frühen 1990er Jahren ist es auch in den Vereinigten Staaten verfügbar.
Flunitrazepam wird seit 1985 in einer mehrstufigen Synthese aus 4-Chloranilin und 2-Fluorbenzoylchlorid hergestellt.[3][4]
Wirkung
Flunitrazepam bindet an spezifische Benzodiazepinrezeptoren im Zentralnervensystem und verstärkt die dort natürlicherweise vorhandenen Hemm-Mechanismen, an denen der Neurotransmitter GABA (gamma-Aminobuttersäure) beteiligt ist. Flunitrazepam beeinflusst die GABA-eigenen Transmissionen schon in wesentlich kleineren Dosen als andere Benzodiazepin-Derivate. Der sedative Effekt ist ungefähr 7- bis 10-mal stärker als der von Diazepam. Da der Wirkstoff nach oraler Einnahme sehr schnell und nahezu vollständig vom Körper aufgenommen wird, tritt die Wirkung etwa 15 bis 20 Minuten nach der Anwendung ein und hält zwischen 4 und 7 Stunden an. Einige Effekte können bis 12 Stunden nach der Anwendung auftreten.
Nebenwirkungen
Wie bei Benzodiazepinen. Eine Abhängigkeit kann nicht nur bei Missbrauch, sondern auch bei therapeutischer Anwendung schon nach zwei Wochen eintreten.
In einer kritischen Analyse relevanter Studien hinsichtlich einer möglichen Einschränkung der Fahrtüchtigkeit im Straßenverkehr nach Einnahme von Flunitrazepam kommen [5] zu dem Schluss, dass darüber trotz der Menge der bislang gesammelten Daten unter Forschern kein Konsens gefunden werden konnte. Die vermutete beeinträchtigende Wirkung von Flunitrazepam auf die Fahrtüchtigkeit konnte weder bestätigt noch widerlegt werden. Dennoch gilt, dass selbst bei bestimmungsgemäßem Gebrauch dieses Arzneimittel das menschliche Reaktionsvermögen so weit verändern kann, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder ein Bedienen von Maschinen beeinträchtigt wird. Deshalb sollten grundsätzlich während der Behandlungsdauer mit Flunitrazepam sowie 24 Stunden nach der letzten Verabreichung des Medikaments keine Kraftfahrzeuge gesteuert oder andere Tätigkeiten ausgeführt werden, mit denen ein Patient sich selbst oder andere gefährden könnte.
Dies gilt in verstärktem Maße bei gleichzeitiger Einnahme von Alkohol, da dieser zusammen mit Flunitrazepam selbst 10 Stunden nach der letzten Dosis noch zu einer stärkeren Beeinträchtigung der Bewegungsabläufe und des geübten Verhaltens führen kann.
Besonders bei Kindern und älteren Patienten besteht die Möglichkeit von „paradoxen“ (gegenteiligen) Reaktionen. Dann treten statt Beruhigung erhöhte Aggressivität, akute Erregungszustände, Angst, vermehrte Muskelkrämpfe, Ein- und Durchschlafstörungen, Albträume, Halluzinationen, depressive Verstimmungszustände oder gelegentlich sogar Selbstmordgefährdung auf. Die Behandlung mit Flunitrazepam kann dann nicht fortgeführt werden.
Anwendung in der Schwangerschaft
Es gibt klare Hinweise auf Risiken für den menschlichen Fetus. Flunitrazepam sollte während der Schwangerschaft nicht angewendet werden. Benzodiazepine wie Flunitrazepam sind relativ lipophil und können die Plazentaschranke passieren. Die Anwendung in hohen Dosen von Benzodiazepinen in der späteren Phase der Schwangerschaft kann beim Neugeborenen Muskelhypotonie auslösen.[6][7]
Missbrauch
In Kombination mit Alkohol oder Opioiden kann es zu einer Amnesie (Gedächtnislücke) kommen, daher hat Flunitrazepam den Ruf einer Date-Rape-Droge: Opfer von Vergewaltigungen oder anderen Straftaten können sich oft an keine Details zum Hergang erinnern. Besonders in den 1990er Jahren wurden die damals farb- und geschmacklosen Tabletten für diesen Zweck missbraucht, meist indem sie Getränken beigemischt wurden. 1999 änderte der Hersteller die Zusammensetzung, so dass die seitdem hergestellten Tabletten eine bläuliche Farbe aufweisen, Flüssigkeiten verfärben, klumpen und einen leicht bitteren Geschmack haben. In einigen Ländern sind die alten Tabletten jedoch noch immer erhältlich und werden außerdem von einigen Generikaherstellern und anderen Firmen immer noch in der alten Form in den Handel gebracht.
Ende der 1990er Jahre wurde das Betäubungsmittelgesetz dahingehend geändert, dass zunächst die Menge pro Packung nicht mehr als 20 mg betragen durfte. Das hatte zur Folge, dass die bis dahin in 20er-Schachteln erhältlichen Tabletten zu 2 mg nur noch in 10er Schachteln angeboten wurden. Eine weitere Novellierung des BtMG im Jahre 1998 führte dazu, dass die Höchstmenge pro abgeteilter Form (also Tablette oder Ampulle) nicht mehr als 1 mg Flunitrazepam enthalten durfte.
Mit der 25. Verordnung zur Änderung betäubungsmittelrechtlicher Vorschriften vom 3. März 2011 hat die Bundesregierung der BRD beschlossen, Flunitrazepam ausnahmslos den Vorschriften des BtMG zu unterstellen. Dieser Änderungsverordnung hat der Bundesrat in seiner 882. Plenarsitzung am 15. April 2011 zugestimmt (BR-Drs 130/11). Es gab eine Übergangsfrist von sechs Monaten ab Verkündung dieser Änderungsverordnung im Bundesgesetzblatt. Diese Frist endete am 1. November 2011. Seitdem sind Flunitrazepam-haltige Arzneimittel in Deutschland nur noch mit BtM-Rezept erhältlich.[8]
In den USA ist Flunitrazepam nicht als Medikament zugelassen und gilt als illegale Droge. Die Einfuhr zum "persönlichen Gebrauch" blieb bei entsprechendem Nachweis und der Anmeldung beim Zoll jedoch lange möglich. Auf diesem Weg gelangten jährlich etwa 1,5 Millionen Einheiten Flunitrazepam (je 2mg) legal in die USA, bis 1996 auch diese Form der Einfuhr verboten wurde.[9] Trotz der im Vergleich zu Deutschland relativ großzügigen Verschreibungspraxis anderer Benzodiazepine besteht in vielen US-Regionen ein Schwarzmarkt für Flunitrazepam. Insbesondere im Süden der USA, entlang der Grenze zu Mexiko ist die Substanz relativ leicht und vergleichsweise günstig erhältlich.
Flunitrazepam wird auch von Konsumenten illegaler Drogen eingenommen. Die Tabletten sind am Schwarzmarkt als „Ruppies“, „Ruffies“, „Roofies“ (vor allem in Amerika unter diesem Namen üblich) oder „R2“, im deutschsprachigen Raum aber vor allem als „Flunies/Flummis“ (nach dem Inhaltsstoff Flunitrazepam), „Ropse“, „Ro(s)chies“ (nach der Hersteller-Firma Roche) oder „Ropys“ bekannt. Speziell in Österreich werden häufig die Namen „Roiperl“, „Ro“, „Rippal“, „Benzos“ (für Benzodiazepine im Allgemeinen) oder „Summal“ bzw. „Somnerln“ (nach dem Handelsnamen Somnubene) gebraucht. Stark verbreitet ist das Mittel insbesondere in „Junkie“-Szenen, in denen Flunitrazepam – alternativ oder ergänzend zu Opiaten – zumeist gespritzt wird. Aber auch unter Partydrogen-Konsumenten ist das Mittel teilweise geläufig, u. a. zum „Runterkommen“ nach dem Konsum halluzinogener Drogen.
Handelsnamen
Monopräparate
Fluninoc (D), Guttanotte (A), Rohypnol (D, A, CH), Somnubene (A) sowie einige Generika (D)
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.4. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d Datenblatt Flunitrazepam bei Sigma-Aldrich, abgerufen am 1. April 2011.
- ↑ W. Hafely, E. Kyburz, M. Gerecke, H. Möhler, Adv. Drug Res. 14:165–322 (1985).
- ↑ F. von Bruchhausen, S. Ebel, A.W. Frahm, E. Hackenthal: Hagers Handbuch der pharmazeutischen Praxis: Band 8, Stoffe E–O. 5. Auflage, Birkhäuser, 1993, ISBN 3-540-52688-9, S. 243.
- ↑ RM. Kaufmann et al. (2004): Flunitrazepam und Fahrtüchtigkeit. Fortschr Neurol Psychiat. 72; 503–515; PDF (freier Volltextzugriff)
- ↑ Fachinformation des Arzneimittel-Kompendium der Schweiz: Rohypnol®, Stand: März 2004.
- ↑ Kanto JH: Use of benzodiazepines during pregnancy, labour and lactation, with particular reference to pharmacokinetic considerations. In: Drugs. 23, Nr. 5, Mai 1982, S. 354–380. PMID 6124415 . Abgerufen am 15. Mai 2010.
- ↑ Fünfundzwanzigste Verordnung zur Änderung betäubungsmittelrechtlicher Vorschriften. Verordnung der Bundesregierung, Bundesrat Drucksache 130/11 vom 3. März 2011.
- ↑ USA verhängen Einfuhrverbot für Flunitrazepam
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 27.04. 2012 aus dem Internet abgerufen.
|
 |
 |
|
Midazolam
Midazolam (Handelsname u. a. Dormicum) ist ein Arzneistoff aus der Gruppe der Benzodiazepine. Es ist verschreibungspflichtig und liegt in Darreichungsformen zur parenteralen und oralen Verabreichung vor. Es kann schon nach kurzer Anwendung zu einer psychischen Abhängigkeit kommen.
Klinische Angaben
Wirkungsprofil
Entsprechend seinem Charakter als besonders potentes Benzodiazepin besitzt Midazolam durch einen identischen Wirkmechanismus die gleichen Wirkungen und Nebenwirkungen wie alle anderen Substanzen dieser Gruppe.
Indikationen und Abgrenzung
Als Hypnotikum wird Midazolam in der Anästhesie und im Rettungsdienst als Bestandteil der Narkose eingesetzt. Bei geplanten Operationen verwendet man es wegen seiner Wirkung der anterograden Amnesie (reduzierten Merkfähigkeit) und der Anxiolyse (Angstverminderung) zur Prämedikation. In der Intensivmedizin wird es als Dauerinfusion über eine Spritzenpumpe zur Sedierung benutzt. Es wird erfolgreich zur Durchbrechung von epileptischen Anfällen eingesetzt (holenzephal deprimierende Wirkung).
Midazolam hat ähnlich wie die (Notfall-) Kurzhypnotika Propofol und Etomidat keine analgetische (schmerzstillende) Wirkung. Die zusätzliche Gabe eines Analgetikums ist daher in Schmerzzuständen unerlässlich. Zur alleinigen Sedierung hingegen ist Midazolam ausreichend.
Anwendung während Schwangerschaft und Stillzeit
Es gibt klare Hinweise für Risiken des menschlichen Fötus in Verbindung mit Benzodiazepin-Verabreichung während der Schwangerschaft. Besondere Vorsicht ist geboten, wenn gegen Ende der Schwangerschaft und unter der Geburt Benzodiazepine verwendet werden, da es beim Fötus zu unregelmäßiger Herzfrequenz und Hypotonie und beim Neugeborenen unter Umständen zu mangelhaftem Saugen, Atemdepression, verminderter Aktivität, herabgesetztem Muskeltonus («floppy-infant» Syndrom) sowie Entzugssymptomen und Hypothermie kommen kann. Im Tierversuch gab es zudem Hinweise auf Verhaltensstörungen der Nachkommen von Muttertieren, denen während der Schwangerschaft Benzodiazepine verabreicht wurden. Midazolam sollte deshalb in der Schwangerschaft nicht angewendet werden, es sei denn, es ist klar notwendig. Da Midazolam in die Muttermilch übertreten kann, darf es bei stillenden Müttern nicht angewendet werden.[4]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Midazolam verstärkt wie alle Benzodiazepine im zentralen Nervensystem die Wirkung des körpereigenen Überträgerstoffes Gamma-Aminobuttersäure (GABA). GABA wirkt im ZNS meist hemmend auf die Nervenzellen. Die Plasmahalbwertszeit beträgt 1,5–2,5 Stunden.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Nach Aufnahme wird der Wirkstoff in der Leber hauptsächlich vom CYP3A4 verstoffwechselt und über die Nieren ausgeschieden. Hauptmetabolit ist das 1-Hydroxymidazolam.
Toxikologie
Die Wirkung von Midazolam lässt sich schnell durch die Gabe des Antidots (Gegenmittels) Flumazenil aufheben.
Chemische und pharmazeutische Aspekte
Midazolam ist ein Derivat aus der Reihe der Imidazobenzodiazepine. Neben der freien Base werden zwei Salze vermarktet, das Midazolammaleat und das Midazolamhydrochlorid. Diese beiden Salze unterscheiden sich nicht in der biologischen Aktivität.
Handelsnamen
Midazolam wird von Hoffmann-La Roche unter dem Handelsnamen Dormicum vertrieben und ist heute auch als Generikum im Handel.
Rechtlicher Status
In den Niederlanden gehört Midazolam zu den Liste II-Drogen des Opiumgesetzes (Opiumwet). Midazolam ist in den Listen der kontrollierten Substanzen der Konvention über psychotrope Substanzen unter den Tabelle IV-Drogen aufgeführt. In Großbritannien ist Midazolam auf der Liste III der kontrollierten Drogen.
Einzelnachweise
- ↑ a b c Datenblatt Midazolam beim EDQM, abgerufen am 23. Juni 2008.
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 1066, ISBN 978-0-911910-00-1.
- ↑ Datenblatt Midazolam hydrochloride bei Sigma-Aldrich, abgerufen am 10. April 2011.
- ↑ Fachinformation des Arzneimittel-Kompendium der Schweiz: Dormicum, Ampullen; Stand der Informationen: November 2005.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 27.04. 2012 aus dem Internet abgerufen.
|
 |
 |
|
Nitrazepam
Nitrazepam (Handelsname z. B. Mogadan®; Ersthersteller Hoffmann-La Roche) ist ein Arzneistoff aus der Gruppe der Benzodiazepine, mit ausgeprägten hypnotischen und antikonvulsiven Eigenschaften und wird zur symptomatischen Behandlung von Schlafstörungen und in der Behandlung der juvenilen Epilepsie eingesetzt. Es kann schon nach kurzer Anwendung zu einer psychischen und körperlichen Abhängigkeit kommen.
Klinische Angaben
Anwendungsgebiete (Indikationen)
Nitrazepam wird rasch und umfassend aus dem Verdauungstrakt in den systemischen Kreislauf aufgenommen. Durch die große hypnotische Wirksamkeit ist es deshalb zur symptomatischen Kurzzeitbehandlung von Insomnie (Schlafstörungen) von klinisch bedeutsamen Schweregrad, die zum Beispiel durch Überbeanspruchung, Angst, Sorge usw. entstehen, angezeigt. Bei organisch bedingten Schlafstörungen muss auch eine kausale Therapie der Grundkrankheit in Erwägung gezogen werden. Aufgrund der mittellangen Plasmahalbwertszeit (t1/2 = 15–30 Stunden) können Hang-over-Effekte (Müdigkeitsphänomene am Tag, vor allem nach dem Aufstehen) und eine Kumulationsneigung nach wiederholter Gabe vorkommen. Der durch Nitrazepam induzierte Schlaf unterscheidet sich vom normalen Schlaf. Während zwei Stadien des orthodoxen Schlafes verlängert sind, ist ein Stadium verkürzt. Hingegen wird der REM-Schlaf nur wenig beeinflusst. Nitrazepam wurde durch die neueren Arzneistoffe, wie z. B. Midazolam, oder die so genannten Nicht-Benzodiazepine Zopiclon, Zolpidem und Zaleplon ersetzt und wird heute nur noch bei Kleinkindern und bettlägerigen Patienten verwendet.
Nitrazepam wird in der adjuvanten Behandlung der Blitz-Nick-Salaam-Anfälle eingesetzt. Auch bei Kindern, die an einem Lennox-Gastaut-Syndrom mit myoklonisch-astatischen Anfällen leiden, wird es verwendet. Die genannten Epilepsie-Syndrome stellen insgesamt ein therapeutisches Problem dar. Ein Therapieversuch sollte wie die Behandlung dieser Epilepsien überhaupt dem Spezialisten vorbehalten sein.[3]
Gegenanzeigen (Kontraindikationen)
Nitrazepam ist kontraindiziert bei Patienten mit bekannter
- Überempfindlichkeit gegenüber dem Wirkstoff und den pharmazeutischen Hilfsstoffen
- bei schwerer respiratorischen Insuffizienz
- Schlafapnoe
- schwere chronische Hyperkapnie
- Myasthenia gravis pseudoparalytica (schwere Muskelschwäche)
- Suchtgefährdete; Alkoholismus
- schwere Leberinsuffizienz
- Zerebelläre und spinale Ataxien (Störungen der Gleichgewichtsregulation und der Bewegungskoordination)
Wechselwirkungen mit anderen Medikamenten
Von wenigen Ausnahmen abgesehen zeigt Nitrazepam bei richtiger Dosierung im Allgemeinen keine klinisch relevanten Interaktionen mit anderen Arzneistoffen. In therapeutischen Dosen verursacht Nitrazepam keine Enzyminduktion und kann daher gleichzeitig mit anderen Arzneistoffen, wie Antikoagulanzien oder oralen Antidiabetika appliziert werden.
Anwendung während Schwangerschaft und Stillzeit
Nitrazepam passiert die Plazentaschranke und erreicht in der Spätschwangerschaft im fetalen Plasma gleiche Konzentrationen wie im maternalen. Es darf deshalb nur in Ausnahmefällen bei zwingenden Gründen angewendet werden. Bei längerer Einnahme des Arzneimittels durch Schwangere können bei Neugeborenen Entzugserscheinungen auftreten. Eine Anwendung gegen Ende der Schwangerschaft oder während der Geburt kann beim Neugeborenen zu einer Hypothermie (erniedrigte Körpertemperatur), Hypotonie (Blutdruckabfall), Atemdämpfung, Muskelhypotonie (herabgesetzte Muskelspannung) und Trinkschwäche führen. Deshalb ist die Anwendung von Nitrazepam im letzten Trimenon der Schwangerschaft kontraindiziert. Nitrazepam passiert die Plazentaschranke und tritt in die Muttermilch über. Es kann sich nach mehrmaliger Gabe dort anreichern, daher muss bei wiederholter Einnahme oder Einnahme hoher Dosen abgestillt werden.
Besondere Patientengruppen (Diabetiker, Nierenkranke)
Da der Qo-Wert von Nitrazepam hoch ist (Qo= 1), ist keine Dosisanpassung bei eingeschränkter Nierenfunktion notwendig. Bei vielen Arzneimitteln mit hohem Qo-Wert entstehen renal eliminierte Metaboliten, deren Aktivität nicht immer bekannt ist. Entsprechend ist bei schweren Einschränkungen der Nierenfunktion grundsätzlich Vorsicht geboten.[4]
Unerwünschte Wirkungen (Nebenwirkungen)
Akute Nebenwirkungen:
- Unter den akuten Nebenwirkungen bei der oralen Therapie mit Nitrazepam stehen Müdigkeit, Schläfrigkeit, Konzentrationsschwäche sowie die Beeinträchtigung der Konzentration und des Reaktionsvermögens im Vordergrund. Dadurch wird die Fähigkeit zur Teilnahme am Straßenverkehr und zur Bedienung von Maschinen beeinträchtigt.
Nebenwirkungen bei chronischer Anwendung:
- Beim chronischen Gebrauch von Nitrazepam besteht vor allem die Gefahr der Toleranz und Abhängigkeit von psychotropen Substanzen..
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Der psychotrope Arzneistoff Nitrazepam aus der Wirkstoffgruppe der 1,4-Benzodiazepine bindet mit hoher Affinität an spezifische Benzodiazepinrezeptoren im ZNS. Nitrazepam verstärkt die hemmende Wirkung der GABA-ergen Übertragung auf unterschiedliche Neuronenverbände. Hieraus resultieren die spannungs-, erregungs- und anxiolytischen (angstdämpfenden) Eigenschaften sowie sedierenden und hypnotischen Effekte. Darüber hinaus zeigt Nitrazepam muskelrelaxierende (Muskeltonus dämpfende) und antikonvulsive Eigenschaften.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Nitrazepam wird mit individuellen Unterschieden (60–90 %) aus dem Gastrointestinaltrakt resorbiert. Etwa 40–80 Minuten nach Einnahme von 5 mg Nitrazepam werden im Blutplasma Höchstwerte von durchschnittlich 40 ng pro ml erreicht. Das Verteilungsvolumen beträgt bei jungen Patienten 2 Liter/kg. Die Plasmaproteinbindung liegt bei 90 %. Nach oraler Verabreichung beträgt die Bioverfügbarkeit 80 %. Die metabolische Umwandlung in der Leber besteht in Reduktion zur 7-Amino-Verbindung, die ihrerseits in 7-Acetamidonitrazepam umgewandelt wird. Die optimale Wirkkonzentration dürfte bei 40 ng Nitrazepam pro ml Blutplasma liegen. Die Elimination von Nitrazepam aus dem Blut erfolgt biphasisch. Die durchschnittliche Eliminationshalbwertzeit liegt bei 30 Stunden. Unter chronischer Verabreichung ändert sich diese Eliminationshalbwertzeit nicht. Bei kontinuierlicher Einnahme von 5 mg Nitrazepam täglich wird das Fließgleichgewicht (Steady-State) mit Konzentrationen von etwa 40–60 ng Nitrazepam pro ml Plasma um den vierten Tag erreicht. Im Urin erscheinen nur wenige Prozente der oral verabreichten Dosen als unverändertes Nitrazepam.
Toxikologie
Die Benzodiazepine haben eine große therapeutische Breite, somit ist eine Überdosierung oder akzidentelle Vergiftung von Nitrazepam im Allgemeinen nicht lebensbedrohlich, es sei denn, dass es zusammen mit anderen ZNS-wirksamen Substanzen – einschließlich Alkohol – eingenommen wurde. Intoxikationen mit Benzodiazepinen sind gewöhnlich – in Abhängigkeit von der aufgenommenen Dosis – durch verschiedene Stadien der zentralen Dämpfung gekennzeichnet, die von Somnolenz, geistiger Verwirrung Lethargie, Sehstörungen und Dystonie bis hin zu Ataxie, Bewusstlosigkeit, zentraler Atem- und Kreislaufdepression und Koma reichen können.
Bei leichteren Vergiftungserscheinungen sollten Patienten unter Beobachtung der Vitalfunktionen (Atem- und Kreislaufkontrolle) ausschlafen. In schwereren Fällen können weitere Maßnahmen (Magenspülung, Kreislaufstabilisierung, Intensivüberwachung) erforderlich werden. Bei erhaltenem Bewusstsein ist es sinnvoll, vorher frühzeitig Erbrechen auszulösen. Auf Grund der hohen Plasmaproteinbindung und des großen Verteilungsvolumens dürften forcierte Dialyse oder Hämodialyse bei reinen Nitrazepamvergiftungen nur von geringem Nutzen sein.
Zur Aufhebung der zentraldämpfenden Wirkungen von Nitrazepam ist der selektive Benzodiazepin- Antagonist Flumazenil (Handelsname Anexate®) angezeigt. Flumazenil ist ein Imidazobenzodiazepin, das mit einer hohen Spezifität kompetitiv und reversibel an die zentralen Benzodiazepinrezeptoren bindet und dabei die Wirkungen der Benzodiazepine antagonisieren kann. Aufgrund seiner strukturchemischen Analogie zu den Benzodiazepinen hat Flumazenil eine hohe Affinität für die Benzodiazepinbindungsstelle am GABAA-Rezeptor. Flumazenil wirkt als Antagonist und schwacher partieller Agonist. Alle Wirkungen der Benzodiazepinrezeptoragonisten können durch Flumazenil aufgehoben werden. Flumazenil antagonisiert die anxiolytischen, muskelrelaxierenden, sedativen und amnestischen Wirkungen. Flumazenil führt zu keinen schwerwiegenden Nebenwirkungen und beeinflusst weder die Herzfrequenz noch den Blutdruck.
Sonstige Informationen
Chemische und pharmazeutische Informationen
Der chemische Name von Nitrazepam nach IUPAC-Nomenklatur lautet: 7-Nitro-5-phenyl-2,3-dihydro-1H-1,4-benzodiazepin-2-on. Es gehört somit zur Gruppe der Benzodiazepine. Nitrazepam ist ein gelbes, kristallines Pulver, das einen Schmelzpunkt von 224–226 °C aufweist. Die Verbindung ist in Ethanol, Aceton, Chloroform und Essigsäureethylester löslich. Hingegen ist sie in Wasser, Diethylether und Hexan praktisch unlöslich.[1] Die Prüfung auf Identität nach Ph.Eur.5. Ausgabe erfolgt mit Hilfe der Infrarotspektroskopie durch Vergleich des Spektrums der Substanz mit dem von Nitrazepam CRS.
Gesetzliche Angaben
Deutschland: Als Vertreter aus der Wirkstoffgruppe der Benzodiazepine unterliegt Nitrazepam in der Bundesrepublik Deutschland der Gesetzgebung des Betäubungsmittelgesetzes (BtMG). Hier ist es in der Anlage III (verkehrsfähige und verschreibungsfähige Betäubungsmittel) aufgenommen worden. EINSCHRÄNKUNG BTM: ausgenommen in Zubereitungen, die ohne einen weiteren Stoff der Anlagen I bis III BtMG bis zu 0,5 vom Hundert als Tropflösung, jedoch nicht mehr als 250 mg je Packungseinheit, oder je abgeteilte Form bis zu 10 mg Nitrazepam enthalten.
Schweiz: Nitrazepam untersteht dem Betäubungsmittelgesetz und ist in der Betäubungsmittelverordnung im Anhang b – Verzeichnis der von der Kontrolle teilweise ausgenommenen betäubungsmittelhaltigen Stoffe und Präparate – aufgeführt und ist ohne Limitatio in der Spezialitätenliste. Das bedeutet, dass Nitrazepam in der Abgabekategorie B eingeordnet ist und auf einem normalen Rezeptformular verschrieben werden kann. Das Rezept darf ohne Zustimmung des Arztes nicht repetiert werden. Nitrazepam wird von der obligatorischen Grundversicherung normal vergütet.[5]
Handelsnamen
Monopräparate:
- Dormo-Puren (D)
- Imeson (D)
- Mogadan (D)
- Mogadon (A, CH)
- Novanox (D)
- Radedorm (D)
- Generika (D)
Literatur
- Hermann J. Roth: Medizinische Chemie : Targets und Arzneistoffe ; 157 Tabellen. Dt. Apotheker-Verlag, Stuttgart 2005, ISBN 3-7692-3483-9
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 5. AUSGABE. 5.0–5.8, 2006.
- W. Forth, D. Henschler, W. Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. URBAN & FISCHER, München 2005, ISBN 3-437-42521-8.
- Patent US3121076 .
Einzelnachweise
- ↑ a b c d e f The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; ISBN 978-0-911910-00-1
- ↑ a b c d Datenblatt Nitrazepam bei Sigma-Aldrich, abgerufen am 16. April 2011.
- ↑ Fachinformation Mogadon®
- ↑ Dosisanpassung bei Niereninsuffizienz bei Dosing
- ↑ Anhang b – Verzeichnis der von der Kontrolle teilweise ausgenommenen betäubungsmittelhaltigen Stoffe und Präparate
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 27.04. 2012 aus dem Internet abgerufen.
|
 |
 |
|
Temazepam
Temazepam ist ein Benzodiazepin. Es ist ein mittellang wirksames Benzodiazepin mit einer Halbwertszeit von 5 bis 13 Stunden. Es kann schon nach kurzer Anwendung zu einer psychischen und körperlichen Abhängigkeit kommen.
Geschichte
Seit der Entdeckung durch Hans Franz wurde Temazepam als Gel-gefüllte Kapsel produziert, die oral eingenommen werden sollte. In Großbritannien und besonders in Schottland wurde es allerdings bekannt, dass, wenn die Kapseln geschmolzen und eingespritzt wurden, der Effekt viel stärker und ähnlicher dem des Alkohols war. Jedoch hat die Flüssigkeit die Tendenz, in den Gefäßen zu erstarren und somit arterielle Thrombosen zu verursachen.
Rechtsstatus in Deutschland
Temazepam ist in der Bundesrepublik Deutschland aufgrund seiner Aufführung in der Anlage 3 BtMG ein verkehrsfähiges und verschreibungsfähiges Betäubungsmittel. Der Umgang ohne Erlaubnis oder Verschreibung ist grundsätzlich strafbar. Weitere Informationen sind im Hauptartikel Betäubungsmittelrecht in Deutschland zu finden.
Ausgenommen sind Zubereitungen, die keine weiteren Betäubungsmittel enthalten und je abgeteilter Form bis zu 20 mg Temazepam enthalten.
Anwendung in der Schwangerschaft und Stillzeit
Temazepam darf in der Schwangerschaft nicht benutzt werden. Es kann bei der Verabreichung von Temazepam während der Spätphase der Schwangerschaft oder während der Entbindung beim Neugeborenen zu Hypothermie, Hypotonie und zu mäßiger Atemdepression kommen. Außerdem könnten Neugeborene von Müttern, die im letzten Trimester der Schwangerschaft Benzodiazepine regelmäßig einnahmen, eine Abhängigkeit aufweisen, mit dem Risiko, dass sie in der postnatalen Phase Entzugssymptome entwickeln. Tierversuche lassen vermuten, dass die Säuglingssterblichkeit durch Temazepam erhöht wird.[3]
Isomerie
Temazepam enthält ein Stereozentrum. Folglich gibt es also zwei Enantiomere dieses Arzneistoffes, das (R)- und das (S)-Isomer. In der Regel besitzen die Enantiomeren unterschiedliche pharmakokinetische und pharmakologische Eigenschaften, dies ist bei Temazepam jedoch nicht relevant, da in wässriger Lösung sehr schnell Racemisierung eintritt, die Anwendung eines reinen Enantiomeren also gar nicht möglich ist [4].
Handelsnamen
Monopräparate
Normison (CH), Planum (D), Remestan (D), Temazep (D)
Einzelnachweise
- ↑ a b c d e Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.1. Georg Thieme Verlag KG, Stuttgart 2008.
- ↑ a b c Datenblatt Temazepam bei Sigma-Aldrich,
- abgerufen am 23. April 2011.
- ↑ Fachinformation des Arzneimittel-Kompendium der Schweiz: Normison®/- mite, Stand der Informationen: August 2005.
- ↑ Miklós Simonyi, Joseph Gal und Bernhard Testa: Sings: The Code of Clarification, in Miklós Simonyi (Herausgeber), Problems and Wonders if Chiral Molecules, Akadémiai Kiadó, Budapest, 1990, S. 127−136, ISBN 963-05-5881-5.
|
 |
 |
|
Der obige Ergänzungsartikel wurde aus der Freien Enzyklopädie Wikipedia übernommen und entsprechend der geltenden GNU-Lizenz veröffentlicht. Eine möglicherweise aktuellere Version finden Sie auf den Seiten der Wikipedia. Eine Liste der Autoren finden Sie auf der entsprechenden Wikipediaseite unter dem Punkt “Versionen/Autoren”. Weitergehende Informationen und Hinweise finden Sie auf unserer Impressumseite. Anmerkung der u~m~d~h~T: Wir machen darauf aufmerksam, daß politische Passagen im Zuge unserer Statuten stark gekürzt, bzw. nicht übernommen wurden. Der obige Ergänzungsartikel wurde am 27.04. 2012 aus dem Internet abgerufen.
|
|
|
|
 |
|
Diese Seite als PDF-Download
|
|
|
|
|